
【题目】A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质。
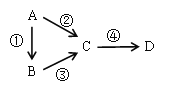
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式_________________________________。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式____________________________________。实验室中检验气体B存在用的试剂或用品为________________。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________。请写出②的离子方程式_________________________________。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱。写出反应④的离子方程式_________________________________________________________。
【答案】2H2S+SO2=3S+2H2O 4NH3+5O2![]() 4NO+6H2O 湿润的红色石蕊试纸 第三周期第ⅢA族 2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑ 2Na2O2+2H2O=4Na++4OH-+O2↑
4NO+6H2O 湿润的红色石蕊试纸 第三周期第ⅢA族 2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑ 2Na2O2+2H2O=4Na++4OH-+O2↑
【解析】
(1) A是一种淡黄色固体且C是形成酸雨的主要物质,这样可以推出A为单质硫。C为SO2,而B为H2S。
(2)C、D是形成光化学烟雾的一个重要原因,可以推出为氮的氧化物。由此B为NH3。检验NH3用,湿润的红色石蕊试纸。
(3)B、D既能溶于强酸溶液,又能溶于强碱溶液,推出为Al元素。又因为②③均需要强碱性溶液,所以A为Al,B为Al2O3.
(4)因为C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱。所以C为Na2O2。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】若某原子在处于能量最低状态时,外围电子排布为![]() ,则下列说法错误的是
,则下列说法错误的是
A. 该元素可能有+3价
B. 该元素位于第5周期副族
C. 该元素原子核外共有39个不同运动状态的电子
D. 该元素基态原子第N能层上还有5个空轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。利用生物发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:

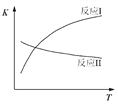
已知:反应I和反应II的平衡常数随温度变化曲线如图所示。
(1)反应I中,1 mol CH3CH2OH(g)参与反应后的热量变化是256 kJ。
① H2O的电子式是:_________________。
② 反应I的热化学方程式是:___________________________。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。
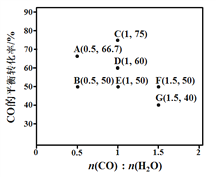
① 图中D、E两点对应的反应温度分别为TD和TE。判断:TD_______TE(填“<” “=”或“>”)。
② 经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的____相同。
③ 当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是______。
(3)反应III,在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如下图所示。
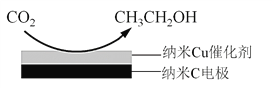
① 阴极的电极反应式是__________________________。
② 从电解后溶液中分离出乙醇的操作方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
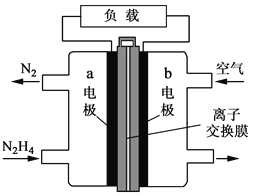
A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向氨水中加入盐酸至中性,溶液中![]() <1
<1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为___________________。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为______________。
(3)NH3的沸点比PH3高,原因是___________;PO43-离子的立体构型为___________。
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为______________。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因_____________________。
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm(1pm=10-12m),阿伏加德罗常数的值为NA,则该晶体的密度为__________________g/cm3(只要求列算式,不必计算)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为:
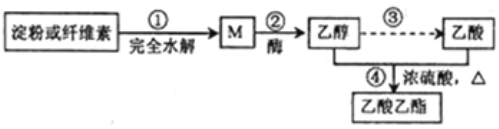
下列说法不正确的是( )
A. 加热条件下,M能与新制氢氧化铜悬浊液发生反应
B. ④的反应类型属于酯化反应,也属于取代反应
C. 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
D. 用饱和碳酸钠溶液可以鉴别乙醇、乙酸和乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵被广泛用于医药、干电池、织物印染、洗涤等领域。氯化铵T1温度下有以下平衡:![]()
(1)N原子最外层电子有______种运动状态;上述平衡中物质,在晶体时属于离子晶体的是__________。
(2)![]() 的电子式为______________。
的电子式为______________。
(3)Cl的非金属性强于S,用原子结构的知识说明理由:_________________。
(4)上述该反应的平衡常数表达式为____________________________________。
(5)在2L密闭容器中建立平衡,不同温度下氨气浓度变化正确的是_________。

(6)T1温度在2L,容器中,当平衡时测得![]() 为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得
为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得![]() 为bmol/L。试比较a与b的大小a_____b(填“>”“<”或“=”),并说明理由:___________。
为bmol/L。试比较a与b的大小a_____b(填“>”“<”或“=”),并说明理由:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A为278g/mol。B、D、E、F、G是氧化物且B为红棕色固体,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是黄绿色气体。O是白色沉淀(图中部分反应物和生成物没有列出)。

(1)写出A、G、L的化学式A______________:G: _______________,L:______________。
(2)反应②的化学方程式 ________________________________________________。
(3)写出反应M→L的离子方程式为________________________________________。
(4)若将O敞口久置,变质过程中的现象为___________________________________,发生的化学方程式为__________________________________________________。
(5)向M溶液中投入与M等物质的量的Na2O2,反应的离子方程式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com