
已知1 mol NaOH与HCl完全反应放出57.4 kJ的热量。下列热化学方程式书写正确的是( )
A.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=+28.7 kJ·mol-1
NaCl(aq)+H2O(l) ΔH=+28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=-28.7 kJ·mol-1
NaCl(aq)+H2O(l) ΔH=-28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=+57.4 kJ·mol-1
NaCl(aq)+H2O(l) ΔH=+57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.3盐类水解的应用试卷(解析版) 题型:选择题
关于盐类水解的实质,下列叙述正确的是( )
A.盐的电离平衡被破坏
B.水的电离平衡被破坏
C.没有中和反应发生
D.溶液的pH一定变大
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.2.2 pH的计算试卷(解析版) 题型:选择题
将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液中的c(H+)最接近于( )
A.1/2(10-8+10-10) mol·L-1
B.(10-8+10-10) mol·L-1
C.(1×10-14+5×10-5) mol·L-1
D.2×10-10 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)2.3.3化学平衡常数试卷(解析版) 题型:选择题
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g) 2Z(g),其平衡常数为1 600
2Z(g),其平衡常数为1 600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)1.1中和反应反应热的测定(解析版) 题型:填空题
已知H+(aq)+OH-(aq) H2O(l) ΔH=-57.3 kJ·mol-1,回答下列问题。
H2O(l) ΔH=-57.3 kJ·mol-1,回答下列问题。
(1)用含20 g NaOH的稀溶液跟足量稀盐酸反应放出 kJ的热量。
(2)用含2 mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热的ΔH= 。
(3)如果将(1)反应中的稀盐酸换成稀醋酸,反应放出的热量 (填“大于”“小于”或“等于”)原来(1)放出的热量。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步练(人教选修4)2.3化学平衡状态的建立及标志(解析版) 题型:填空题
下列可以证明H2(g)+I2(g) 2HI(g)已达平衡状态的是 。
2HI(g)已达平衡状态的是 。
①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2)
④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步练(人教选修4)2.3化学平衡状态的建立及标志(解析版) 题型:选择题
下列说法可以证明反应N2(g)+3H2(g) 2NH3(g)已达到平衡状态的是( )
2NH3(g)已达到平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.N2、H2、NH3的分子数之比为1∶3∶2
D.1个N≡N键断裂的同时,有6个H—N键形成
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铜及其化合物主要性质、合金(解析版) 题型:选择题
某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是
A.铜与浓硫酸反应所得白色固体不是CuSO4
B.加BaCl2溶液后所得白色沉淀是BaSO3
C.白色固体中夹杂的少量黑色物质可能是CuO
D.白色固体中夹杂的少量黑色物质中一定含有元素Cu和S
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
如图是现今常规生产发烟硫酸和硫酸的流程图:
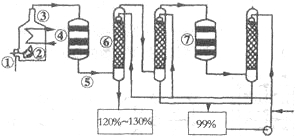
(1)在④处二氧化硫被氧化成三氧化硫,④的设备名称是 ,该处发生反应的方程式为 ,为提高三氧化硫的产率,该处应采用 (填“等温过程”或“绝热过程”)为宜。
(2)在⑦处进行二次催化处理的原因是 。
(3)⑤处气体混合物主要是氮气和三氧化硫.此时气体经过⑥后不立即进入⑦是因为 。
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水 吨(保留2位有效数字)才能配制成98%的成品硫酸。
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧.试简述这种燃烧方式对环境保护是有利的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com