
【题目】18.4g由铁、铜组成的混合粉末加入100mL5.0molL﹣1FeCl3溶液中,充分反应后,剩余固体质量为3.2g。下列说法正确的是( )
A.原固体混合物中:n(Cu):n(Fe)=2:1
B.反应后溶液中的溶质有FeCl2、FeCl3、CuCl2
C.反应后溶液中:n(Fe2+)+n(Cu2+)=0.8mol
D.剩余固体是铁
【答案】A
【解析】
铁比铜活泼,因此先发生反应:Fe+2Fe3+=3Fe2+,再发生Cu+2Fe3+=3Fe2++Cu2+,原FeCl3溶液中FeCl3的物质的量n(FeCl3)=5.0molL﹣1×0.1L=0.5mol,结合方程式进行解答。
设0.5mol Fe3+完全反应消耗铁的质量为xg,铜为yg,那么
Fe + 2Fe3+ = 3Fe2+ Cu+ 2Fe3+ = 3Fe2+ + Cu2+
56g 2mol 64g 2mol
xg 0.5mol yg 0.5mol
x=![]() =14g, y=
=14g, y=![]() =16g,溶解的金属的质量为18.4-3.2=15.2g,且有14<15.2<16,说明铁完全反应反应而铜部分反应,有剩余;
=16g,溶解的金属的质量为18.4-3.2=15.2g,且有14<15.2<16,说明铁完全反应反应而铜部分反应,有剩余;
A. 根据分析可知,剩余的3.2g金属为Cu,物质的量为![]() =0.05mol,反应掉的铁和酮的质量为18.4-3.2=15.2g,56n(Fe)+64n(Cu)=15.2,2n(Fe)+2n(Cu)=0.5,解得n(Fe)=0.1mol,n(Cu)=0.15mol,因此铜的物质的量为0.15mol+0.05mol=0.2mol,原混合物中n(Cu):n(Fe)=2:1,A项正确;
=0.05mol,反应掉的铁和酮的质量为18.4-3.2=15.2g,56n(Fe)+64n(Cu)=15.2,2n(Fe)+2n(Cu)=0.5,解得n(Fe)=0.1mol,n(Cu)=0.15mol,因此铜的物质的量为0.15mol+0.05mol=0.2mol,原混合物中n(Cu):n(Fe)=2:1,A项正确;
B.由于铜有剩余,Fe3+完全反应,因此溶液中不存在Fe3+,B项错误;
C.根据方程式可知反应后溶液中n(Fe2+)=0.5+0.1=0.6mol,n(Cu2+)=0.15mol,因此n(Fe2+)+n(Cu2+)=0.75mol,C项错误;
D.剩余的固体是铜,不是铁,D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】A(C6H6O)是一种重要的化工原料,广泛用于制造树脂、医药等。
Ⅰ.以A、B为原料合成扁桃酸衍生F的路线如下。

(1)A的名称是____;B的结构简式是____。
(2)C(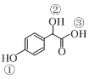 )中①~③羟基氢原子的活性由强到弱的顺序是____。
)中①~③羟基氢原子的活性由强到弱的顺序是____。
(3)D的结构简式是____。
(4)写出F与过量NaOH溶液反应的化学方程式:___________。
(5)若E分子中含有3个六元环,则E的结构简式是________。
Ⅱ.以A为原料合成重要的医药中间体K的路线如下。
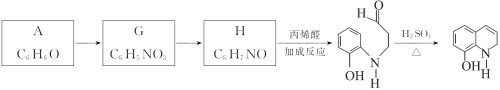
(6)G→H的反应类型是__________。
(7)一定条件下,K与G反应生成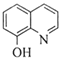 、H和水,化学方程式是__________。
、H和水,化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是( )

A.实验I中溶液红色褪去,说明发生了反应H++OH-![]() H2O
H2O
B.实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中仍然存在大量的Na+与OH
C.实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应2H++SO42-+Ba2++2OH-= 2H2O+BaSO4↓
D.将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出(溶液体积变化忽略不计),所得溶液Q中的![]() ,下列有关说法正确的是
,下列有关说法正确的是
A. 溶液Q比原溶液增重了1.92g.
B. Q中n(Cu2+):n(Fe3+)=3:4
C. 反应中转移的电子数为0.04mol
D. n(Cu2+)=0.03mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在金刚石压腔实验中创造出了前所未见的化合物X,在超过113 GPa的压力下能够保持稳定。X在一定条件下完全分解为A(气体)和B,A的密度约为0.18 g·L1;B是短周期中最活泼的金属;Y为含有C元素的气态氧化物,能使品红溶液褪色,E为常见无机物,Y与E以1∶1发生化合反应生成F,F仅含三种元素,是常用的食品抗氧化剂之一(假设反应过程无损耗,题中均为短周期元素,A、B、C为单质,气体数据均为标准状况下测定)。根据如下转化,回答下列问题:
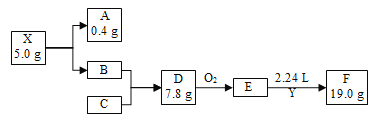
(1) 图中C在元素周期表中的位置是________。
(2) D的电子式为________。
(3) X的化学式为________。
(4) E→F的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl + 2H2O![]() NaOH + Cl2↑+ H2↑
NaOH + Cl2↑+ H2↑
(1)用双线桥表示出电子转移的方向和数目______________题干中反应改写成离子方程式是___________________________________
(2)电解食盐水的过程中,氧化产物是__________________________________
(3)电解食盐水要求对粗食盐水进行精制,以除去租食盐水中含有的泥沙和SO42-、Ca2+,Mg2+等杂质离子。精制时依次加入氯化钡溶液、纯碱、烧碱,充分反应后过滤,在滤液中加入盐酸中和至中性。盐酸与滤液反应的离子方程式:___________________,________________________________.
(4)实验室欲用固体NaOH来配制90ml 0.5 mol/L的NaOH溶液来用于以上除杂,需要称量固体NaOH_______g。配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为__________。在配制过程中,若其它操作均正确,下列操作会引起结果偏低的是___________(填字母)。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中定容
C.容量瓶不干燥,含有少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列各组指定溶液中一定不能大量共存的离子组的个数是( )
①强酸性溶液中:Mg2+、K+、![]() 、
、![]()
②强碱性溶液中:Na+、Ba2+、![]() 、
、![]()
③在无色溶液中:H+、K+、![]() 、F-
、F-
④0.1mol/LBa(NO3)2溶液:Mg2+、K+、![]() 、Cl-
、Cl-
⑤无色透明溶液中:![]() 、K+、Cl-、
、K+、Cl-、![]()
⑥无色透明的碱性溶液中:Na+、Ba2+、Cl-、![]()
A.一个B.两个C.三个D.四个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为2 mol·L-1
B. 上述电解过程中共转移6 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是( )
A. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
B. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
C. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
D. 39g钾与氧气完全反应,生成K2O转移NA个电子,生成KO2转移2NA电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com