
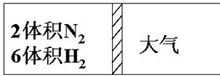
 在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示.容器中发生以下反应:N2+3H2?2NH3(正反应为放热反应).若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:
在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示.容器中发生以下反应:N2+3H2?2NH3(正反应为放热反应).若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:分析 (1)①在恒温恒压下,要使平衡状态与原平衡状态完全等效,可以采用极限转化处理,按化学计量数转化到左边,应满足2体积N2、6体积H2,计算原平衡时氨气的体积,根据氨气体积判断反应进行方向;
②若让反应逆向进行,氨气的体积必须大于原平衡时氨气的体积,最大值则为2体积氮气和6体积氢气完全反应时产生的氨气的体积;
(2)平衡后混合气体为6.5体积<7体积,恒压条件下,应是改变温度影响平衡移动,根据温度对化学平衡移动的影响知识来回答.
解答 解:(1)①反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同,恒温恒压条件下,采用极限分析,按化学计量数转化到左边,应满足2体积N2、6体积H2,2体积的氨气完全转化得到1体积氮气、3体积氢气,故1+a=1+1=2,3+b=6,则b=3,
所以只要a:b=1:3,由于a=1,则b=3,
因反应前混合气体为8体积,反应后混合气体为7体积,体积差为1体积,则:
N2(g)+3H2(g)?2NH3(g) 体积减少
2 2
1体积 1体积
故平衡时氨气为1体积,而在起始时,氨气的体积c=2体积,比平衡状态时大,为达到同一平衡状态,氨的体积必须减小,所以平衡逆向移动,
故答案为:3;逆;
②若让反应逆向进行,由上述①所求出的平衡时氨气为1体积,氨气的体积必须大于1体积,最大值则为2体积氮气和6体积氢气完全反应时产生的氨气的体积,即为4体积,则1<c≤4,
故答案为:1<c≤4;
(2)平衡后混合气体为6.5体积<7体积,恒压条件下,应是改变温度影响平衡移动,由于正反应为放热反应,且是气体总分子数减小的反应,只能为降低温度,
故答案为:降低温度;6.5<7上述平衡需向气体体积缩小方向移动,故可采取降温措施.
点评 本题主要考查了等效平衡、化学平衡影响因素等,注意理解等效平衡原理,注意各物质的量与原平衡相等,按化学计量数转化到左边满足对应物质等量,不能是等比.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 分子发生化学变化时,会生成新的分子,但不会分裂成原子 | |
| B. | 2molH2和1molO2完全反应,结果放出930kJ的热量 | |
| C. | 1molH-H和$\frac{1}{2}$molO-O键的断裂过程共放出930KJ的热量 | |
| D. | 分析变化的全过程,可得出形成H-O键将放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 溶解度:SO2>CO2 | ||
| C. | 酸性:HClO4>H2SO4 | D. | 气态氢化物的稳定性:H2O>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (Ag+) | B. | 溶液的pH | C. | Ag棒的质量 | D. | c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成相差一个或若干个CH2原子团的化合物一定互为同系物 | |
| B. | 互为同分异构体的有机物的组成元素相同,但结构必须不同 | |
| C. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 互为同系物的有机物其相对分子质量数值一定相差14n(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直线 sp杂化 | B. | V型 sp杂化 | ||
| C. | 三角锥形 sp2杂化 | D. | 平面三角形 sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯滴入溴水中,振荡后水层接近无色 | |
| B. | 乙烯使酸性KMnO4溶液褪色 | |
| C. | 乙烯使溴的四氯化碳溶液褪色 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 7:8 | D. | 8:7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com