

| A. | 分子发生化学变化时,会生成新的分子,但不会分裂成原子 | |
| B. | 2molH2和1molO2完全反应,结果放出930kJ的热量 | |
| C. | 1molH-H和$\frac{1}{2}$molO-O键的断裂过程共放出930KJ的热量 | |
| D. | 分析变化的全过程,可得出形成H-O键将放出能量 |
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | B. | A、B、C、D四者共存 | ||
| C. | 消耗A的速率与生成A的速率相等 | D. | D、C的生成速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )| A. | 可用石墨作阴极,铁作阳极 | |
| B. | a为直流电源的负极 | |
| C. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| D. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉水解的最终产物为酒精 | B. | 纤维素水解的最终产物为麦芽糖 | ||
| C. | 油脂水解的产物之一为甘油 | D. | 蛋白质与浓硫酸作用呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
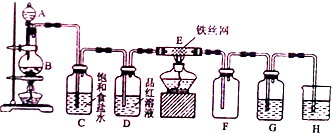
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | NaHCO3溶液中加入稀HCl:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| C. | 实验室制取 Cl2:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H20 | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种物质中均含有硅元素,它们能发生如图所示的化学变化,回答:(已知硅与铝相似也能和氢氧化钠溶液反应生成盐与氢气)
A、B、C、D、E五种物质中均含有硅元素,它们能发生如图所示的化学变化,回答:(已知硅与铝相似也能和氢氧化钠溶液反应生成盐与氢气)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 | |
| B. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 除去蛋白质溶液中的NaCl而不改变它的性质,可加入适量的AgNO3溶液,再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
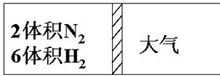 在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示.容器中发生以下反应:N2+3H2?2NH3(正反应为放热反应).若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:
在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示.容器中发生以下反应:N2+3H2?2NH3(正反应为放热反应).若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com