
����Ŀ���״�����Ҫ�Ĺ�ҵԭ��.ú������������ú̿��ȡˮú���Ӷ��ϳɼ״���CO��g��+2H2��g��![]() CH3OH��g�������³�ѹ�·�Ӧ�������仯��ͼ1��ʾ��
CH3OH��g�������³�ѹ�·�Ӧ�������仯��ͼ1��ʾ��
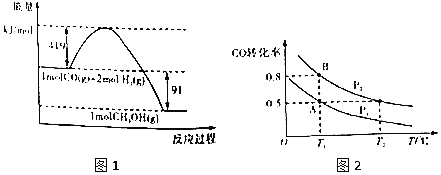
��
��ѧ�� | H��H | H��O | O=O |
����kJ/mol | 436 | x | 496 |
��CO��g��+ ![]() O2��g��=CO2��g�� ��H=-280kJ/mol
O2��g��=CO2��g�� ��H=-280kJ/mol
H2��g��+![]() O2��g��=H2O��l�� ��H=-284kJ/mol
O2��g��=H2O��l�� ��H=-284kJ/mol
H2O��l��=H2O��g�� ��H=+44kJ/mol
��ش��������⣺
��1���״�����ֽ�ΪCO��H2����������һ��Ӧ�Ļ��Ϊ__kJ/mol��
��2����д����ʾ��̬�״�ȼ���ȵ��Ȼ�ѧ����ʽ__��
��3��H��O�ļ���xֵΪ__��
��4����ͼ2����һ�ݻ��ɱ���ܱ������г���10molCO�����30molH2���壬���ﵽƽ��״̬Aʱ�����������Ϊ20L���練Ӧ��ʼʱ�Գ���10molCO��30molH2������ƽ��״̬Bʱ���������V��B��=___L��
��5���ڼס��ҡ���������ͬ�ܱ������а���ͬ��ʽͶ�ϣ�һ�������·����÷�Ӧ����ʼ�¶Ⱥ���ʼ�����ͬ����Ӧ��������ﷴӦǰ���Ϊ��̬��.������������ʾ��
���� | �� | �� | �� |
������� | ���º��� | ���Ⱥ��� | ���º�ѹ |
��Ӧ��Ͷ�� | 1molCO��2molH2 | 1molCH3OH | 1molCH3OH |
ƽ��ʱ������� | V���ף� | V���ң� | V������ |
��Ӧ��ƽ�ⳣ��K | K���ף� | K���ң� | K������ |
ƽ��ʱCH3OH��Ũ��/molL-1 | C���ף� | C���ң� | C������ |
ƽ��ʱCH3OH�ķ�Ӧ����/molL-1min-1 | v���ף� | v���ң� | v������ |
������˵����ȷ����___��
A.V���ף���V������
B.K���ң���K������
C.c���ң���c���ף�
D.v���ף�=v������
���𰸡�510 CH3OH��g��+![]() O2��g��=CO2��g��+2H2O��l����H=-757kJmol-1 462 7 BC
O2��g��=CO2��g��+2H2O��l����H=-757kJmol-1 462 7 BC
��������
���Ϊ����Ӿ��е�������ȼ���ȵ��Ȼ�ѧ����ʽ�У���ȼ��Ϊ1mol����Ӧ�����ȶ����������ͼ1�ɵ��Ȼ�ѧ����ʽ����CO��g��+2H2��l��=CH3OH��g����H=-91kJ/mol����Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ���������x��ֵ���ϳɼ״��ķ�ӦΪ���ȷ�Ӧ����Ϊ���º��ݣ���Ϊ���Ⱥ��ݣ����¶Ƚ��ͣ�ƽ�ⳣ���������º�ѹ�����Ӧ����
(1)��ͼ���֪�״��Ļ��Ϊ��419+91��kJ/mol=510kJ/mol��
(2)ȼ���ȵ��Ȼ�ѧ����ʽ�У���ȼ��Ϊ1mol����Ӧ�����ȶ����������ͼ1�ɵ��Ȼ�ѧ����ʽ����CO��g��+2H2��l��=CH3OH��g����H=-91kJ/mol������֪����CO��g��+![]() O2��g���TCO2��g����H=-280kJ/mol ��H2��g��+
O2��g���TCO2��g����H=-280kJ/mol ��H2��g��+![]() O2��g���TH2O��l����H=-284 kJ/mol�����ݸ�˹���ɣ��ۡ�2+��-�ٿɵ�CH3OH��g��+
O2��g���TH2O��l����H=-284 kJ/mol�����ݸ�˹���ɣ��ۡ�2+��-�ٿɵ�CH3OH��g��+![]() O2��g��=CO2��g��+2H2O��l����H=-757kJmol-1��
O2��g��=CO2��g��+2H2O��l����H=-757kJmol-1��
(3)��֪��H2��g��+![]() O2��g���TH2O��l����H=-284 kJ/mol��H2O��l���TH2O��g����H=+44kJ/mol
O2��g���TH2O��l����H=-284 kJ/mol��H2O��l���TH2O��g����H=+44kJ/mol
������ӿɵã�H2��g��+![]() O2��g���TH2O��g����H=-240 kJ/mol����Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ���436kJ/mol+
O2��g���TH2O��g����H=-240 kJ/mol����Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ���436kJ/mol+![]() ��496kJ/mol-2��x kJ/mol=-240kJ/mol�����x=462��
��496kJ/mol-2��x kJ/mol=-240kJ/mol�����x=462��
(4)A��B�������¶���ͬ������ѧƽ�ⳣ����ȣ���ͼ��֪A��ʱCO��ת����Ϊ50%����ƽ��ʱCO�����ʵ���Ϊ5mol��H2�����ʵ���Ϊ20mol���״������ʵ���Ϊ5mol����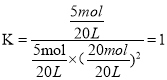 ����B��ʱCO��ת����Ϊ0.8��ƽ��ʱCO�����ʵ���Ϊ��10mol-10mol
����B��ʱCO��ת����Ϊ0.8��ƽ��ʱCO�����ʵ���Ϊ��10mol-10mol![]() 0.8��=2mol��H2�����ʵ���Ϊ��30mol-2
0.8��=2mol��H2�����ʵ���Ϊ��30mol-2![]() 8mol��=14mol���״������ʵ���Ϊ8mol�������ΪVL������K=
8mol��=14mol���״������ʵ���Ϊ8mol�������ΪVL������K=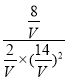 =1�����V=7L��
=1�����V=7L��
(5)A����Ϊ�״��ķֽ⣬�������������ķ�Ӧ�����Ա����º�ѹ���������º��ݣ�������䣬���ԣ�V����V����A����
B���ϳɼ״��Ƿ��ȷ�Ӧ�����淴Ӧ�״��ֽ�������ȵģ��Ҿ��������������£������ҷ�Ӧ��ȱ��¶ȵͣ������ȷ�����еij̶�С��ƽ��ʱ���м״�Ũ�ȱȱ��ߣ�CO������Ũ�ȱȱ��ͣ�K����K����B��ȷ��
C��������ͬʱ���������ǵ�Чƽ�⣮���������������ͬ���ҷֽ�״����ȵ����ұȼ��¶ȵͣ�ƽ����ϳɼ״������ƶ���ƽ��ʱ�״�Ũ���Ҵ��ڼף���c����c����C��ȷ��
D���������ʼ�¶Ⱥ���ʼ�����ͬ�����������·�Ӧ�����ں�ѹ�����·ֽ�״�����������CO��ƽ��ʱ����ȷ�Ӧǰ��ƽ��ʱ��������ڼף���ѹǿ�״��ڱ������Ԧ�����������D����
��ѡBC��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һ��������N2��H2��Ӧ����NH3����ش�
������Ӧ���������ΪE1���������������ΪE2����E1��E2����÷�ӦΪ________(����ȡ����ȡ�)��Ӧ��
����֪��1 molH��H����1 mol N��H����1 mol N��N���ֱ���Ҫ��������436 kJ��391 kJ��946 kJ����N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ________________��
��2��ʵ������50 mL 0.50 mol��L��1������50mLijŨ�ȵ�NaOH��Һ����ͼ��ʾװ���з�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ���װ�������ԵĴ�������һ����ȱ��һ�ֲ���������������������Ϊ____________��ʵ�����ṩ��0.50 mol��L��1��0.55 mol��L��1����Ũ�ȵ�NaOH��Һ��Ӧѡ��_____________mol��L��1��NaOH��Һ����ʵ�顣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ�У�������ȷ��ʾ��Ӧ��ɫ�仯����
A.��ʢ��NO2���ܷⲣ������������ˮ�У���ɫ��dz��2NO2![]() N2O4
N2O4
B.������Ħ��������NaCl��Һ�б�ڵ�����(��ɫ����ΪAg2S)�������ܿ�ָ�����ɫ��Ag2S��2NaCl===Na2S��2AgCl
C.�Ȼ�������Һ�����軯����Һ������ɫ������3FeCl2+2K3[Fe(CN)6]===Fe3[Fe(CN)6]2����6KCl
D.FeCl3��Һ�м���ͭ�ۣ���Һ�ӻ�ɫ��Ϊ����ɫ��2FeCl3��Cu===2FeCl2��CuCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ɼ���п������Բ��ѻ����ɣ����е�Բ��֮��з��ż�����ˮ�ݹ��IJ�����ͼ��ʾΪ����ķ�����ģ�ͣ��ɰ���п����������ɵ�Բ��ѻ����ɡ�����˵����ȷ����
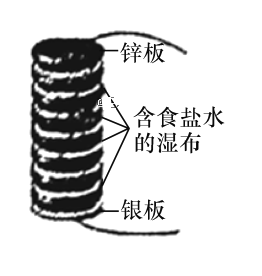
A.�õ�ط����ķ�ӦΪ���ⸯʴ
B.��س�ʱ�乤�����м�IJ��ϻ��а�ɫ����������ɣ��ù������ΪAg2O
C.����·��ת��0.1 mol����ʱ������п���������Ϊ26 g
D.�÷����ѹ���ʱ�������帽������Cl2�ų�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й������У���ȷ����
A. һ���¶��£���0.1mol/L�İ�ˮ�еμ���ͬŨ�ȵĴ��ᣬc(NH4+)/c(NH3��H2O) ��С
B. ��֪Ksp(BaSO4) = 1.1��10��10�� Ksp(BaCO3) = 2.58��10��9�����Բ��ܽ�BaSO4ת��ΪBaCO3
C. ��������Һ�ζ�ǿ����Һʱ���ü�����ָʾ��
D. ����FeCl3��Һʱ��Ϊ������ˮ�⣬�ɼ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ����ᴿ�г��Ӽ�����Ӧ�Ļ�ѧ����ʽ�ֱ�Ϊ��
�����ɷ� | �����Լ� | ��ѧ����ʽ |
��i��ͭ���л������� | __ | __ |
��ii������������� | __ | __ |
��iii��Al2O3���Al��OH��3 | __ | __ |
��iv��FeCl3��Һ�л���FeCl2 | __ | __ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ����������ȼ�ϵ�صĹ���ԭ����ͼ���õ�ط�ӦΪ��Mg+ClO��+H2O�TMg��OH��2+Cl�������й�˵����ȷ���ǣ�������

A. ��ع���ʱ��C��Һ�е�������MgCl2
B. ��ع���ʱ������a������pH����������
C. ������Ӧʽ��ClO����2e��+H2O�TCl��+2 OH��
D. b�缫������ԭ��Ӧ��ÿת��0.1mol���ӣ�����������0.1mol Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaC2��MgC2�������ӻ��������������ȷ���ǣ� ��
��CaC2��MgC2����ˮ��Ӧ������Ȳ
��C![]() �ĵ���ʽΪ
�ĵ���ʽΪ![]()
��CaC2��ˮ����Ca2+��C![]() ��ʽ����
��ʽ����
��MgC2���۵�ͣ�������100������
A.�٢�B.�ڢ�C.�٢�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʣ���Cl2 ��Na2O2 ��NaOH ��HCl ��H2O2 ��MgF2 ��NH4Cl
��1��ֻ�ɷǼ��Լ����ɵ�������___�����ţ���ͬ����
��2�������Ӽ��ͼ��Լ����ɵ�������___��
��3�����ڹ��ۻ������������___��
��4����H2O2�ĵ���ʽΪ��___��
��5���õ���ʽ��ʾ��MgF2���γɹ��̣�___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com