
| A. | 需要加热的化学反应都是吸热反应 | |
| B. | 放热反应都不需要加热就可以发生 | |
| C. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| D. | 化学反应放热还是吸热,取决于反应条件 |
分析 A.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
B.有的放热的化学反应需要加热才能发生;
C.化学反应在发生物质变化的同时还伴随着能量的变化;
D.反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小,与条件无关.
解答 解:A.放热反应有的需加热,有的不需加热.如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点.再如铝热反应也是,故A错误;
B.有的放热的化学反应需要加热才能发生,例如物质燃烧,故B错误;
C.化学反应在发生物质变化的同时还一定伴随着能量的变化,故C正确;
D.因反应条件与反应吸热还是放热无关,反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小,故D错误.
故选C.
点评 该题考查了吸热反应与放热反应,能量变化的原因.需正确理解放热吸热的本质,是解题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
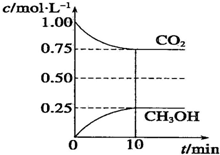 在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-akJ.mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-akJ.mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着 | |
| B. | 苯在一定温度、压强和催化剂的作用下和氢气反应,生成环己烷 | |
| C. | 乙烯通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色 | |
| D. | 将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOC2H5+H2O;④2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;⑤CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O.
CH3COOC2H5+H2O;④2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;⑤CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com