
已知在25℃时:2C(s)+O2(g)=2CO(g) △H1=-222kJ/mol
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
C(s)+O2(g)=CO2(g) △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为
A.-82kJ/mol B.-41kJ/mol C.-312kJ/mol D.+82kJ/mol
 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、-82kJ/mol | B、-41kJ/mol | C、-312kJ/mol | D、+82kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)(1)已知在25℃时:①2CO (s)+ O2 (g)==2CO2 (g) △H1=-566KJ/mol
②C (s)+O2 (g)==CO2 (g) △H2=-394KJ/mol,则碳与氧气反应生成一氧化碳的热化学方程式为:__________________________________________________;
(2)在体积为2 L的密闭容器中,A与B在一定条件下反应生成C:
A (g)+2B (s) 2C (g)。反应达到平衡时,平衡常数表达式K= _______ ;在不同温度下达到平衡时生成物C的物质的量如下图所示,则该反应是 反应(填“放热”或“吸热” )。在500℃,从反应开始到平衡,C的平均反应速率v(C) = 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年天津市蓟县一中高二第三次月考化学试卷(带解析) 题型:填空题
(选做题)(10分)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是____
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”) 大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度的大小关系是:
。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh= 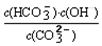 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省新民市高三上学期期末考试化学试卷(解析版) 题型:选择题
已知在25℃时:
①2C(石墨)+O2(g)=2CO(g) △H1=-222kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
③C(石墨)+O2(g)=CO2 △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为:
A.-82kJ/mol B.-41kJ/mol C.-312kJ/mol D.+41kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com