
【题目】有A、B、C、D四种金属片,进行如下实验:①A、B用导线连接后浸入稀H2SO4中,电流由B ![]() 导线
导线 ![]() A;②C、D用导线相连后,同时伸入稀H2SO4 溶液中,C极为负极;③A、C相连后同时浸入稀H2SO4 中,C极产生大量气泡;④B、D相连后同时浸入稀H2SO4 中,D极发生氧化反应;试判断四种金属的活动顺序是( )
A;②C、D用导线相连后,同时伸入稀H2SO4 溶液中,C极为负极;③A、C相连后同时浸入稀H2SO4 中,C极产生大量气泡;④B、D相连后同时浸入稀H2SO4 中,D极发生氧化反应;试判断四种金属的活动顺序是( )
A.A>C>D>BB.A>B>C>DC.B>A>C>DD.B>D>C>A
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于Fe3+、Fe2+性质实验的说法正确的是( )
A.用如图装置不可以制备沉淀Fe(OH)2
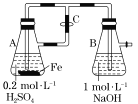
B.配制FeCl3溶液时,直接将FeCl3晶体溶于水即可
C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象确定溶液中含有Fe2+
D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M均为短周期主族元素,原子序数依次增大,X质子总数与电子层数相同,Y元素的一种同位素可用于考古时测定一些文物的年代,Z的气态氢化物可以与Cl2反应产生白烟,用来检验氯气管道是否泄漏。Y、Z、W位于同一周期,且最外层电子数之和为15,M的质子数是X、Y、Z、W四种元素质子数之和的![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.简单离子半径M>W>Z>X
B.M2W2与足量的CO2完全反应,转移2 mol电子时增重28 g
C.X、Z两种元素只能组成化学式为ZX3的化合物
D.由X、Z、W三种元素形成的化合物既有共价化合物也有离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如图所示。吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是( )
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是( )
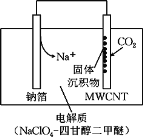
A.“吸入”CO2时的正极反应:4Na++ 3CO2+ 4e-= 2Na2CO3+ C
B.“吸入”CO2时,钠箔为正极
C.“呼出”CO2时,Na+向多壁碳纳米管电极移动
D.标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置在铁棒表面镀上一层铜,下列有关的判断正确的是
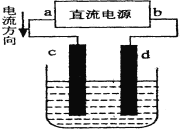
A.a为阳极、b为阴极B.c为铁棒、d为铜棒
C.电子流向从b→d→c→aD.溶液中Cu2+向d极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl2 6H2O的流程如下:
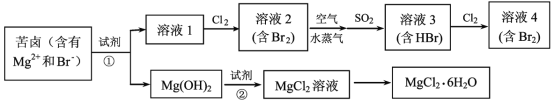
(1)写出一种海水淡化的方法_____。
(2)比较溶液中Br2的浓度:溶液2_____溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是_______。
(4)试剂①可以选用__________,加入试剂②后反应的离子方程式是_________。
(5)从MgCl2溶液获得MgCl2 6H2O晶体的主要操作包括_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是( )
A.煤炭中起作用的主要元素是碳
B.该冶炼锌的方法属于热还原法
C.倭铅是指金属锌和铅的混合物
D.冶炼Zn的反应方程式为ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷、烯、炔都是常见的碳氢化合物。
(1)写出下列有机物的系统命名法名称:
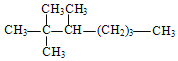 名称是_____
名称是_____
(2)有下列有机物:①CH3CH3 ②CH2=CH2 ③CH3﹣CH2﹣C≡CH ④CH3﹣C≡ C﹣CH3 ⑤C6H12 ⑥CH3﹣CH=CH2,其中互为同系物的是_____,互为同分异构体的是_____ (填编号)
(3)实验室常用浓硫酸和乙醇混合加热制取乙烯。
①实验室制乙烯的化学方程式为_____。
②关于该实验的说法中正确的是_____
a.浓硫酸只有催化剂的作用
b.可用向下排空气法收集乙烯
c.在反应容器中放入几片碎瓷片防止混合液暴沸
d.温度计应插入反应溶液液面下,以便控制温度
(3)实验后期制得的乙烯气体中常含有杂质气体 SO2和CO2,将此混合气体直接通入溴水中,若 观察到溴水褪色,能否证明乙烯发生了加成反应?_____(填“能”或“否”),原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。
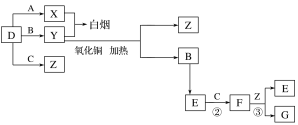
请回答下列问题:
(1)D的化学式为__,Y的化学式为__,E的化学式为__。
(2)Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为__。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__。
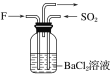
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?__,理由是__。
【答案】H2 NH3 NO 2NH3+3CuO![]() N2+3Cu+3H2O 6NO+4NH3
N2+3Cu+3H2O 6NO+4NH3![]() 5N2+6H2O 有 二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀
5N2+6H2O 有 二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀
【解析】
A、B、C、D是四种常见气体单质.E的相对分子量比F的小16,且F为红棕色,可推知F为NO2,E为NO,C为O2,B为N2,结合转化关系,气体单质D、A反应得到X,气体单质D与B反应得到Y,X与Y反应冒白烟,应是氨气与HCl反应,可推知D为氢气、A为氯气、X为HCl、Y为氨气,D与C反应生成Z为水,F与Z反应生成G为HNO3,据此解答。
A、B、C、D是四种常见气体单质.E的相对分子量比F的小16,且F为红棕色,可推知F为NO2,E为NO,C为O2,B为N2,结合转化关系,气体单质D、A反应得到X,气体单质D与B反应得到Y,X与Y反应冒白烟,应是氨气与HCl反应,可推知D为氢气、A为氯气、X为HCl、Y为氨气,D与C反应生成Z为水,F与Z反应生成G为HNO3;
(1)由上述分析可知,D的化学式为H2,Y的化学式为NH3,E的化学式为NO;
(2)NH3与氧化铜反应,每生成1molN2消耗3mol氧化铜,还原产物中Cu应是化合价为a,则:3(2-a)=2×3,解得a=0,故生成Cu,该反应的化学方程式为:2NH3+3CuO ![]() N2+3Cu+3H2O;
N2+3Cu+3H2O;
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为4NH3+6NO ![]() 5N2+6H2O;
5N2+6H2O;
(4)二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀,故气体NO2和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中,洗瓶中有沉淀生成。
【题型】推断题
【结束】
20
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com