
【题目】以烃A和芳香烃D为原料合成化合物X的路线如图所示:

回答下列问题:
(1)A的名称是_______,F中含有的官能团名称是__________。
(2)E生成F的反应类型是___________。
(3)反应D→E的化学方程式为_______________________________。
(4)反应F→H的化学方程式为_________________________________。
(5)X的结构简式为________________,下列有关X的说法正确的是________(填字母)。
a.能发生水解反应 b.能发生银镜反应
c.不能使溴的四氯化碳溶液褪色 d.能与浓硝酸发生取代反应
(6)芳香族化合物M是G的同分异构体,M能与NaHCO3溶液反应产生气体,符合条件的M有_____种,其中核磁共振氢谱有6组峰且峰面积之比为1:2:2:2:2:1的是____________(填结构简式)。
【答案】乙炔羟基水解反应(或取代反应)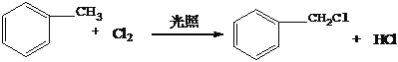
![]()
![]() ad14
ad14
【解析】
烃A和B反应为加成反应,根据B的分子式可以知道,A为HC≡CH,B为CH3CHO,B发生氧化反应生成 C为CH3COOH,根据E和H的分子式及E转化成F,F转化成H的条件 可以知道,E为![]() ,E发生碱性水解生成醇F为
,E发生碱性水解生成醇F为![]() ,F发生氧化反应生成H为
,F发生氧化反应生成H为![]() ,所以芳香烃D为甲苯,C和F在浓硫酸作用下发生酯化反应生成G为
,所以芳香烃D为甲苯,C和F在浓硫酸作用下发生酯化反应生成G为![]() ,G与H发生信息②中的反应生成X为:
,G与H发生信息②中的反应生成X为:![]() ,据以上分析解答。
,据以上分析解答。
烃A和B反应为加成反应,根据B的分子式可以知道,A为HC≡CH,B为CH3CHO,B发生氧化反应生成 C为CH3COOH,根据E和H的分子式及E转化成F,F转化成H的条件 可以知道,E为![]() ,E发生碱性水解生成醇F为
,E发生碱性水解生成醇F为![]() ,F发生氧化反应生成H为
,F发生氧化反应生成H为![]() ,所以芳香烃D为甲苯,C和F在浓硫酸作用下发生酯化反应生成G为
,所以芳香烃D为甲苯,C和F在浓硫酸作用下发生酯化反应生成G为![]() ,G与H发生信息②中的反应生成X为:
,G与H发生信息②中的反应生成X为:![]() ;
;
(1) 据以上分析可知A为HC≡CH,名称是乙炔;F为![]() ,含有的官能团是羟基;综上所述,本题答案是:乙炔;羟基。
,含有的官能团是羟基;综上所述,本题答案是:乙炔;羟基。
(2)根据上面的分析可以知道,E生成F的反应类型是取代反应(或水解反应);综上所述,本题答案是:水解反应(或取代反应)。
(3)D为甲苯,和氯气光照发生侧链上的取代反应,所以反应D→E的化学方程式为: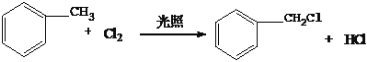 ;综上所述,本题答案是:
;综上所述,本题答案是: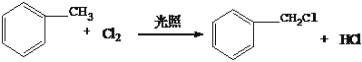 。
。
(4)据以上分析可知,醇发生催化氧化生成醛,F发生氧化反应生成H,化学方程式为:![]() ;综上所述,本题答案是:
;综上所述,本题答案是:![]() 。
。
(5)根据上面的分析可以知道,X的结构简式为![]() ;
;
a.X中有酯基,能发生水解反应,故正确;
b.X中没有醛基,所以不能发生银镜反应,故错误;
c.X有碳碳双键,能使Br2的CCl4溶液褪色,故错误;
d.X中有苯环,能与浓硝酸发生取代反应,故正确;
综上所述,本题答案是:![]() ,ad。
,ad。
(6)G为![]() ,芳香族化合物M是G的同分异构体,M能与NaHCO3溶液反应产生气体,说明有羧基,符合条件的M为苯环上连有一个基团为-CH2CH2COOH或-CH(CH3)COOH,也可以是连有两个基团为-CH3、-CH2COOH或为-CH2CH3、-COOH,每种都有邻间对三种,也可以是三种基团为-CH3、-CH3、-COOH,根据定二动一的原则有6种,所以共有1+1+3+3+6=14种;其中核磁共振氢谱有6组峰且峰面积之比为1:2:2:2:2:1的是:
,芳香族化合物M是G的同分异构体,M能与NaHCO3溶液反应产生气体,说明有羧基,符合条件的M为苯环上连有一个基团为-CH2CH2COOH或-CH(CH3)COOH,也可以是连有两个基团为-CH3、-CH2COOH或为-CH2CH3、-COOH,每种都有邻间对三种,也可以是三种基团为-CH3、-CH3、-COOH,根据定二动一的原则有6种,所以共有1+1+3+3+6=14种;其中核磁共振氢谱有6组峰且峰面积之比为1:2:2:2:2:1的是: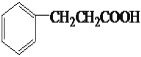 ;综上所述,本题答案是:14,
;综上所述,本题答案是:14,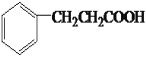 。
。


科目:高中化学 来源: 题型:
【题目】根据反应Br+H2![]() HBr+H的能量随反应历程的变化示意图甲进行判断,下列叙述中不正确的是
HBr+H的能量随反应历程的变化示意图甲进行判断,下列叙述中不正确的是
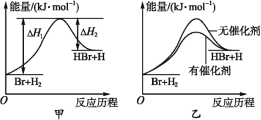
A. 正反应吸热
B. 加入催化剂,该化学反应的反应热不变
C. 加入催化剂后,该反应的能量随反应历程的变化示意图可用图乙表示
D. 加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某Na2CO3溶液中逐滴滴加1 mol·L-1的盐酸,测得溶液中Cl-、HCO的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法中正确的是( )

A.Oa段反应的离子方程式与ab段反应的离子方程式相同
B.该Na2CO3溶液中含有1 mol Na2CO3
C.b点的数值为0.6
D.b点时生成CO2的物质的量为0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O
B. 充电时,当阳极质量增加23.9 g时,溶液中有0.2 mol电子通过
C. 放电时,正极区pH增大
D. 充电时,Pb电极与电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅相关资料得知:i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
回答下列问题:
(1)将铬铁矿矿石粉碎的目的是________________________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)操作II中加入H2O2的目的__________________________________
(4)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(5)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe元素化合物的物质的量为___________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法不正确的是( )
A. 实验室用H2O2分解制O2,加MnO2做催化剂后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用锌和盐酸反应制取氢气,用锌粉比锌粒反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)可作为新型汽车动力燃料,以下是甲醇在工业上的制备过程:

请回答下列问题:
(1)在一定条件下反应室Ⅰ中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
(2)在容积不变的条件下,不能说明反应室Ⅰ中的反应已达到平衡状态的是____(选填字母标号)
a.CO的物质的量不在改变 b.容器内的压强保持不变
c.CH4的消耗速率与生成速率相等 d.容器内的密度保持不变
(3)在容积为1L反应室Ⅱ中充入1molCO与2molH2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
(4)氢氧燃料电池的反应原理示意图如图所示。
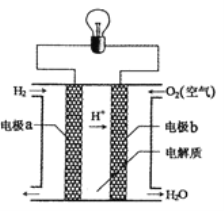
该电池中电极b是_____(填“正极”或“负极”),其电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]
聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT的一种合成路线如图所示:
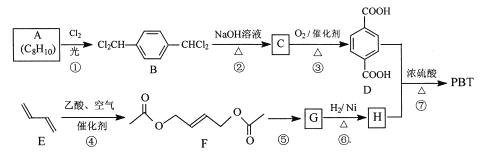
回答下列问题:
(1)A的结构简式是_________,C的化学名称是_________。
(2)⑤的反应试剂和反应条件分别是__________。
(3)F的分子式是_________,⑥的反应类型是_________。
(4)⑦的化学方程式是_________。
(5)M是H的同分异构体,同时符合_列条件的M可能的结构有_________种。
a.0.1 molM与足量金属钠反应生成氢气2.24 L(标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱显不3组峰,且峰而积之比为3:1:1的结构简式是_________。
(6)以2一甲基-1-3一丁二烯为原料(其它试剂任选),设计制备![]() 的合成路线:_________
的合成路线:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中
是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中![]() 等重金属的除去及烟气的脱硫脱硝。回答下列问题:
等重金属的除去及烟气的脱硫脱硝。回答下列问题:
(1)将过硫酸纳![]() 溶液加入亚氯酸钠
溶液加入亚氯酸钠![]() 中可制备
中可制备![]() 中
中![]() 元素的化合价是___________,该反应中氧化剂和还原剂的物质的量之比为________。
元素的化合价是___________,该反应中氧化剂和还原剂的物质的量之比为________。
(2)将![]() 通入
通入![]() 溶液,溶液中可检测到
溶液,溶液中可检测到![]() 同时有黑色
同时有黑色![]() 沉淀生成。该反应的离子方程式为:________________________
沉淀生成。该反应的离子方程式为:________________________
(3)为研究![]() 脱硝的适宜条件,在1 L 200 mg·L-1
脱硝的适宜条件,在1 L 200 mg·L-1![]() 溶液中加
溶液中加![]() 溶液调节
溶液调节![]() ,通入
,通入![]() 气体并测定
气体并测定![]() 的去除率,其关系如下图所示:
的去除率,其关系如下图所示:

①实验中使用的![]() 溶液的物质的量浓度为____________;要使
溶液的物质的量浓度为____________;要使![]() 的去除率更高,应控制的条件是__________________________。
的去除率更高,应控制的条件是__________________________。
②当溶液![]() 时,
时,![]() 的去除率增大的原因是
的去除率增大的原因是![]() 与
与![]() 溶液反应生成更强的吸收剂
溶液反应生成更强的吸收剂![]() ,写出碱性条件下
,写出碱性条件下![]() 脱除
脱除![]() 反应的离子方程式:____________
反应的离子方程式:____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com