
【题目】向下列溶液中通入足量相应气体后,各离子组还能大量存在的是
A. 二氧化碳:K+、Na+、CO32-、Cl- B. 氨气:Mg2+、Al3+、Na+、NO3-
C. 氯化氢:Ca2+、Fe3+、NO3-、Cl- D. 氯气:Na+、Ba2+、HCO3-、HSO3-
【答案】C
【解析】
A.由于CO2![]() CO32-
CO32-![]() H2O=HCO3-,所以通入CO2,溶液中的CO32-不能大量共存,故不选A;
H2O=HCO3-,所以通入CO2,溶液中的CO32-不能大量共存,故不选A;
B.由于Mg2+![]() 2NH3·H2O=Mg(OH)2
2NH3·H2O=Mg(OH)2![]() 2NH4+,Al3+
2NH4+,Al3+![]() 3 NH3·H2O=Al(OH)3
3 NH3·H2O=Al(OH)3![]() 3NH4+,所以通入氨气溶液中的Mg2+、Al3+不能大量共存,故不选B;
3NH4+,所以通入氨气溶液中的Mg2+、Al3+不能大量共存,故不选B;
C.通入HCl溶液中的. Ca2+、Fe3+、NO3-、Cl-不会发生任何反应,可以大量共存,故选C;
D.在含有Na+、Ba2+、HCO3-、HSO3-的溶液中通入Cl2, HSO3-被氧化成SO42-进而生成BaSO4沉淀,HCO3-生成H2O和CO2气体,所以不能大量共存,故不选D;
本题答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
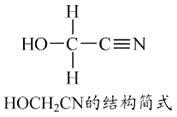
(1)Zn2+基态核外电子排布式为____________________。
(2)1 mol HCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
(5)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) ![]() CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
① 此反应的化学平衡常数表达式为________;
② 下列能增大碳的转化率的措施是________ 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4(g) +3/2O2(g) ![]() CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是_______(填“X”或“Y”或“Z”),选择的理由是_______。
(3)合成气合成甲醇的主要反应是:2H2(g)+CO(g) ![]() CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
① 该时间段内反应速率v(H2)=______ mol·L-1·min-1。
② 此时,正、逆反应速率的大小:v正______v逆(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是____________。
(5)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2 + 4KOH=2K2CO3+6H2O该电池负极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式 | CH3COOH | HCN | H2C2O4 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=5.9×10-2,K2=6.4×10-6 |
下列有关说法正确的是( )
A. CH3COOH溶液与Na2CO3反应生成CO2可以证明乙酸是弱酸
B. H2C2O4溶液的电离方程式为 H2C2O4![]() 2H+ + C2O42-
2H+ + C2O42-
C. 加水稀释HCN溶液,促进HCN的电离且c(CN-)/c(OH-)增大
D. 在Na2C2O4 溶液中加入足量的CH3COOH溶液发生反应的离子方程式为 C2O42- + CH3COOH=CH3COO- + HC2O4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓盐酸与次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是( )
①CO2 ②HCl ③H2O(g)
A.①②③B.②③C.①②D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一组探究氯气性质的装置。

(1)现关闭活塞K,若有色布条是干燥的,溶液A为浓硫酸,则有色布条________;若溶液A为水,则有色布条________;若溶液A为饱和的NaHCO3溶液,则有色布条________。
(2)现打开K,溶液A为氢氧化钠溶液,通入的氯气是湿润的,布条是干燥的,则有色布条________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
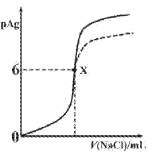
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于2A2(g)+3B2(g)![]() C(g)的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
C(g)的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2)=0.6mol·L-1·s-1B.v(A2)=0.5mol·L-1·s-1
C.v(C)=0.45mol·L-1·s-1D.v(B2)=2.4mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com