
����Ŀ����ȥˮ�������ˮú����Ҫ��H2��CO��CO2��������H2S��CH4��������ȥH2S�ɲ��ô���Ǵ�ת����������CH4ת����CO���õ�CO��CO2��H2�Ļ�����壬������ĺϳɼ״�ԭ������
��1����ˮú������Ҫ��ѧ��Ӧ����ʽΪ��C(s)+H2O(g) ![]() CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
�� �˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ________��
�� ����������̼��ת���ʵĴ�ʩ��________ ��
A������C��s�� B������H2O��g�� C�������¶� D������ѹǿ
��2����CH4ת����CO����ҵ�ϳ����ô�ת���������䷴Ӧԭ��Ϊ��CH4(g) +3/2O2(g) ![]() CO(g) + 2H2O(g) ��H=��519kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ��
CO(g) + 2H2O(g) ��H=��519kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ��
��X��750��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Y��600��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Z��440��ʱ��Ч����ߣ���ʹ�淴Ӧ���ʼӿ�Լ1��106����
����������Ϣ������Ϊ��������Ӧ��ѡ������˴�����_______���X����Y����Z������ѡ���������_______��
��3���ϳ����ϳɼ״�����Ҫ��Ӧ�ǣ�2H2(g)+CO(g) ![]() CH3OH��g����H=��90.8kJ��mol��1 T��ʱ���˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10min���ø���ֵ�Ũ�����£�
CH3OH��g����H=��90.8kJ��mol��1 T��ʱ���˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10min���ø���ֵ�Ũ�����£�
���� | H2 | CO | CH3OH |
Ũ��/��mol��L-1�� | 0.2 | 0.1 | 0.4 |
�� ��ʱ����ڷ�Ӧ����v(H2)=______ mol��L��1��min��1��
�� ��ʱ�������淴Ӧ���ʵĴ�С��v��______v�����������������������
��4�����������У��ϳ���Ҫ����ѭ������Ŀ����____________��
��5���״����Ƴ�����ȼ�ϵ�أ��ܷ�ӦΪ��2CH3OH+3O2 + 4KOH=2K2CO3+6H2O�õ�ظ����ĵ缫��ӦʽΪ______��
���𰸡�K=c(CO)��c(H2)/c(H2O) BC Z ��Ч�ʸ��һ����¶ȵͣ�������Ըߡ��ٶȿ죬��Ӧ�¶ȵͣ� 0.08 �� ���ԭ�������ʣ�����߲���������Ҳ�ɣ� CH3OH��6e- +8OH��=CO32- +6H2O
��������
(1)C(s)��H2O(g)![]() CO(g)��H2(g)��ƽ�ⳣ������ʽΪK=c(CO)c(H2)/c(H2O)������C��ת���ʣ���Ҫʹƽ��������Ӧ�����ƶ���
CO(g)��H2(g)��ƽ�ⳣ������ʽΪK=c(CO)c(H2)/c(H2O)������C��ת���ʣ���Ҫʹƽ��������Ӧ�����ƶ���
A��CΪ���壬����C������ƽ���ƶ���Ӱ�죬��A��ѡ��
B������H2O(g)ƽ��������Ӧ�����ƶ���C��ת��������Bѡ��
C������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ�����Cѡ��
D������ѹǿ��ƽ�����淴Ӧ�����ƶ�����D��ѡ��
��������������ӦѡBC��
(2)���������淴Ӧ���ʵĸı�̶�����ͬ�ģ�Z�Է�Ӧ���ʵ�Ӱ�����Ч�ʸ����һ����¶���ͣ���������߾���Ч�档
(3) ���ɱ������ݿ���֪��, 10min�ڼ״���Ũ�ȱ仯��Ϊ0.4mol��L��1,���ݷ���ʽ2H2(g)+CO(g) ![]() CH3OH��g����֪������Ũ�ȱ仯��Ϊ0.4mol��L��1��2=0.8mol��L��1,����v(H2)= 0.8mol��L��1��10min=0.08 mol��L��1��min��1;
CH3OH��g����֪������Ũ�ȱ仯��Ϊ0.4mol��L��1��2=0.8mol��L��1,����v(H2)= 0.8mol��L��1��10min=0.08 mol��L��1��min��1;
���ɱ������ݿ���֪��,��ʱ��Ũ����Qc=0.4/(0.22��0.1)=100,С��ƽ�ⳣ��160,�ʷ�Ӧ������Ӧ�������,����v����v��;
(4)�÷�ӦΪ���淴Ӧ,������һ����̼��������ȫ��Ӧ,Ϊ���ԭ��������,�Ѽ״��������,��ԭ������ѭ������;
(5)�ڼ״�ȼ�ϵ�������������ͨ����������Ԫ�ػ��ϼ۽��ͣ��õ����ӣ��缫��ӦΪ��2H2O+O2+4e-=4OH-����ظ���ͨ��״���ʧȥ���ӣ��缫��Ӧ�ɸ����ܷ�Ӧ2CH3OH+3O2 + 4KOH=2K2CO3+6H2O��������Ӧ����ø�����ӦΪCH3OH��6e- +8OH��=CO32- +6H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ú�ˮ���ι�ҵ�е�ĸҺ����������þ��һ�ֹ���������������˵���������

A. ��������������δ�漰�û���Ӧ
B. ��Ʋ���١��ڡ��۵���ҪĿ���Ǹ���MgCl2
C. ��ˮʱ��HCl�����н��п�����MgCl2ˮ��
D. ���õ��ij���þ�ۿ��ڵ�������ȴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(H2 NCOONH4)��һ���ֽ⡢��ˮ��İ�ɫ���塣���о�С����Ũ��ˮ���ɱ���Ϊԭ���Ʊ���������淋�ʵ��װ����ͼ1��ʾ������Ҫ��Ӧ��ԭ��Ϊ2NH3(g)+CO2(g)![]() NH2COONH4(s) ��H<0
NH2COONH4(s) ��H<0


(1)����1��������___________������3��ʢװ�Ĺ�����___________����������___________��
(2)����6��һ�������ǿ���ԭ��������Ӧ����ϵ����ַ�Ӧ������Ӧ���ڹ۲쵽װ����Ũ�����в������ݣ���Ӧ��___________(�����ӿ������������������ı���)�������������ʡ�
(3)��һ���Ʊ���������淋ķ�Ӧװ��(Һ��ʯ����CCl4���䵱���Խ���)��ͼ2��ʾ��
��Һ��ʯ������ƿ��������______________________��
�����ޱ�ˮ����������ֽ���������[CO��NH2��2]��д��������������ȷֽ�Ļ�ѧ����ʽ��______________________��
�۵�CCl4Һ���в����϶ྦྷ��������ʱ������ֹͣ��Ӧ�����˷���õ��ֲ�Ʒ��Ϊ�˽����ôֲ�Ʒ����ɲ�ȡ�ķ�����___________(����)��
A.���� B.����Ⱥ�� C.��ѹ���Ⱥ��
(4)�Ƶõİ���������п��ܺ���̼����李�̼����е�һ�ֻ���������(�����ǰ����������ˮ�ķ�Ӧ)��
����Ʒ��������гɷ�̽��������д���пո�
��ѡ�Լ�������ˮ��ϡ���ᡢBaCl2��Һ������ʯ��ˮ��AgNO3��Һ��ϡ���ᡣ
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ����������Ʒ���Թ��У���������ˮ�������ܽ� | �õ���ɫ��Һ |
����2�����Թ��м��������BaCl2��Һ������ | ����Һ������ǣ���֤�������в���̼��� |
����3�����Թ��м�������___________ | ___________����֤�������к���̼����� |
�ڸ��ݢٵĽ��ۡ�ȡ15.8g�����������Ʒ������������������Һ��ִ������ˡ�ϴ�ӡ������ó�������Ϊ1.97g������Ʒ�а�������淋���������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mL0.50 mol/L������50 mL 0.55 mol/L NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ���ⶨǿ����ǿ�Ӧ�ķ�Ӧ�ȡ�

��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ� (t2��t1) /�� | |||
HCl | NaOH | ƽ��ֵ | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ��������� _________��
��2��װ���д�С�ձ�֮����������ĭ���ϵ�Ŀ����______________________________��
��3��ijͬѧʵ���¼���������ϱ���ʾ�����м�¼����ֹ�¶���ָ______________�¶ȡ�
��4�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ_________���ƫ����ƫС��������Ӱ�족����
��5�������ʵ�鷢���кͷ�Ӧʱ�ų�������Ϊ________________kJ(�кͺ����ɵ���Һ�ı�����c=4.18J/(g���� ) ��������λС������
��6�������50 mL0.55mol/L�İ�ˮ(NH3��H2O)����NaOH��Һ��������ʵ�飬ͨ����õķ�Ӧ�ȼ����к��ȣ����H��_________���ƫ����ƫС��������Ӱ�족������ԭ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С������ͼװ�ý���SO2 ��FeCl3��Һ��Ӧ�����ʵ�飨�г�װ������ȥ����

��1�������Ȼ�����Һʱ�����Ȱ��Ȼ��������ܽ��������У��ټ�ˮϡ�ͣ�����������Ŀ����___��
��2��ͨ������SO2ʱ��װ��C�й۲쵽������Ϊ_______________��
��3��������������С��ͬѧ��ΪSO2 �� FeCl3��Һ����������ԭ��Ӧ��
��д��SO2��FeCl3��Һ��Ӧ�����ӷ���ʽ____________��
�ڼ�����Fe2+���ɵķ�����____________��
�۸�С��ͬѧ��C�Թܷ�Ӧ�����Һ�м��������ữ��BaCl2��Һ�������ְ�ɫ����������֤����Ӧ������SO42 -����������������������____________��
��4��Dװ���е���©����������____________��
��5��Ϊ����֤SO2���л�ԭ�ԣ�ʵ���п��Դ���FeCl3���Լ���____________������ĸ����
a.ŨH2SO4 b.����KMnO4��Һ �� c.��ˮ d.NaCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���ɳ���Ԫ����ɵ�һЩ���ʼ��仯����֮���ת����ϵͼ���������ʾ�йص�һ�ַ�Ӧ�����������������Ѿ���ȥ��������A��B��D�ڳ����¾�Ϊ��ɫ��ζ�����壬C����ʹʪ��ĺ�ɫʯ����ֽ���������壬M���������ɫҺ�塣

��1��д��C��E�Ļ�ѧ����ʽ�� ��
��2��ʵ���ҳ��ü������ֹ�������ķ����Ʊ�����C���仯ѧ����ʽΪ�� ������C���� ����д�Լ����ƣ���
��3��E��������D����ʱ����۲쵽 ����������ˮ���ռ�F�������ռ���ƿ���ռ���������Ϊ ����д���ʵĻ�ѧʽ����
��4��д��A��D�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA![]() C��������ӦA��B��C���ɣ�1molA������Ӧ������������ͼ��ʾ�������й�������ȷ����
C��������ӦA��B��C���ɣ�1molA������Ӧ������������ͼ��ʾ�������й�������ȷ����
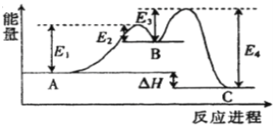
A. A![]() C������ӦΪ���ȷ�Ӧ
C������ӦΪ���ȷ�Ӧ
B. ���������ı�A��C��������
C. A![]() C����Ӧ�Ļ�ܴ������淴Ӧ�Ļ��
C����Ӧ�Ļ�ܴ������淴Ӧ�Ļ��
D. A![]() C�ķ�Ӧ�ȡ�H=E1+E3-E2-E4
C�ķ�Ӧ�ȡ�H=E1+E3-E2-E4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ��ͨ��������Ӧ����������黹�ܴ������ڵ���
A. ������̼��K+��Na+��CO32����Cl�� B. ������Mg2+��Al3+��Na+��NO3��
C. �Ȼ��⣺Ca2+��Fe3+��NO3����Cl�� D. ������Na+��Ba2+��HCO3����HSO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A. �μӷ�Ӧ�ķ�Ӧ��������Ǿ�����ѧ��Ӧ���ʵ���Ҫ����
B. ����Ӱ��ijЩ��ѧ��Ӧ���ʵ��������֮һ
C. ������ѧ��Ӧ���ʵ�����Ҫ������Ũ��
D. ����Ũ�ȡ����ȡ���ѹ��ʹ�ô��������Ǽӿ췴Ӧ���ʷ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com