
����Ŀ�����������(H2 NCOONH4)��һ���ֽ⡢��ˮ��İ�ɫ���塣���о�С����Ũ��ˮ���ɱ���Ϊԭ���Ʊ���������淋�ʵ��װ����ͼ1��ʾ������Ҫ��Ӧ��ԭ��Ϊ2NH3(g)+CO2(g)![]() NH2COONH4(s) ��H<0
NH2COONH4(s) ��H<0


(1)����1��������___________������3��ʢװ�Ĺ�����___________����������___________��
(2)����6��һ�������ǿ���ԭ��������Ӧ����ϵ����ַ�Ӧ������Ӧ���ڹ۲쵽װ����Ũ�����в������ݣ���Ӧ��___________(�����ӿ������������������ı���)�������������ʡ�
(3)��һ���Ʊ���������淋ķ�Ӧװ��(Һ��ʯ����CCl4���䵱���Խ���)��ͼ2��ʾ��
��Һ��ʯ������ƿ��������______________________��
�����ޱ�ˮ����������ֽ���������[CO��NH2��2]��д��������������ȷֽ�Ļ�ѧ����ʽ��______________________��
�۵�CCl4Һ���в����϶ྦྷ��������ʱ������ֹͣ��Ӧ�����˷���õ��ֲ�Ʒ��Ϊ�˽����ôֲ�Ʒ����ɲ�ȡ�ķ�����___________(����)��
A.���� B.����Ⱥ�� C.��ѹ���Ⱥ��
(4)�Ƶõİ���������п��ܺ���̼����李�̼����е�һ�ֻ���������(�����ǰ����������ˮ�ķ�Ӧ)��
����Ʒ��������гɷ�̽��������д���пո�
��ѡ�Լ�������ˮ��ϡ���ᡢBaCl2��Һ������ʯ��ˮ��AgNO3��Һ��ϡ���ᡣ
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ����������Ʒ���Թ��У���������ˮ�������ܽ� | �õ���ɫ��Һ |
����2�����Թ��м��������BaCl2��Һ������ | ����Һ������ǣ���֤�������в���̼��� |
����3�����Թ��м�������___________ | ___________����֤�������к���̼����� |
�ڸ��ݢٵĽ��ۡ�ȡ15.8g�����������Ʒ������������������Һ��ִ������ˡ�ϴ�ӡ������ó�������Ϊ1.97g������Ʒ�а�������淋���������Ϊ___________��
���𰸡���Һ©�� ��ʯ�� ���ﰱ������ֹ����5�����ɵİ��������ˮ�� �ӿ� ͨ���۲����ݣ�����ͨ��NH3��CO2������ NH2COONH4![]() CO(NH2)2+H2O B ��������ʯ��ˮ ����Һ����� 95.0%
CO(NH2)2+H2O B ��������ʯ��ˮ ����Һ����� 95.0%
��������
��1����������1���ص㣬����1����Ϊ��Һ©�����ѹ��Һ©���������������һ���ֽ⡢��ˮ��İ�ɫ���壬��˰�����Ҫ���������3��ʢ�ż�ʯ�һ���ʯ�һ�NaOH���壬�������Ǹ��ﰱ������ֹ����5�����ɵİ��������ˮ�⣻
��2������������ϡ���ᣬCO2������ϡ���ᣬ����Ӧ���ڹ۲쵽װ����ϡ������Һ�в������ݣ�˵��CO2������Ӧ�üӿ�������������٣�
��3����Һ��ʯ������ƿ��������ͨ���۲����ݣ�����ͨ��NH3��CO2�����ʣ�
�ڰ�����������ȷֽ�����أ���ԭ���غ��֪������ˮ����Ӧ����ʽΪH2NCOONH4![]() CO(NH2)2��H2O��
CO(NH2)2��H2O��
�۰�������������ֽ⣬��ȡ��ѹ���º�ɣ�������Ⱥ�ɣ���B��ȷ��
��4���ٸ��ݵó����ۣ�֤�������к���̼����泥�����Թ��м������������ij���ʯ��ˮ������NH4HCO3��Ca(OH)2=CaCO3����NH3��H2O��H2O������Ϊ��Һ����ǣ�
�ڰ����������Ʒ����������������Һ��ִ��������ɳ����ķ�Ӧ��Ba(OH)2��NH4HCO3=BaCO3����NH3��H2O��H2O��n(NH4HCO3)=n(BaCO3)=![]() ==0.01mol��m(NH4HCO3)=0.01mol��79g��mol��1=0.79g��m(NH2COONH4)=(15.8��0.79)g=15.01g����������淋���������Ϊ15.01/15.8��100%=95.0%��
==0.01mol��m(NH4HCO3)=0.01mol��79g��mol��1=0.79g��m(NH2COONH4)=(15.8��0.79)g=15.01g����������淋���������Ϊ15.01/15.8��100%=95.0%��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2H2(g)��O2(g)===2H2O(l) ��H����571.6kJ��mol��1
CO(g)��1/2O2(g)===CO2(g) ��H����282.8kJ��mol��1
����CO��H2��CO2��ɵĻ������67.2L(��״��)������ȫȼ�պ�ų���������Ϊ710.0kJ��������18gҺ̬ˮ����ȼ��ǰ���������CO���������Ϊ(����)
A. 80% B. 50% C. 60% D. 20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ˮ��Һ��һ���ܴ����������(����)
A. ���д��� Ba2������Һ�У�Cl����K����![]() ��
��![]()
B. ���д���H������Һ�У�Mg2����Na����![]() ��
��![]()
C. ���д���OH������Һ�У�Mg2����![]() ��
��![]() ��
��![]()
D. ���д���Na������Һ�У�H����K����![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[���ʽṹ������]
[Zn(CN)4]2-��ˮ��Һ����HCHO�������·�Ӧ��4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
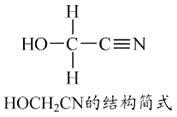
��1��Zn2+��̬��������Ų�ʽΪ____________________��
��2��1 mol HCHO�����к�����������ĿΪ____________mol��
��3��HOCH2CN������̼ԭ�ӹ�����ӻ�������______________��
��4����H2O���ӻ�Ϊ�ȵ������������Ϊ________________��
��5��[Zn(CN)4]2-��Zn2+��CN-��Cԭ���γ���λ���������ǿռ乹�ͣ�[Zn(CN)4]2-�Ľṹ����ʾ��ͼ��ʾΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ��X��Y��Z��W���������������ˮ�ɵ�������Һ��0.010mol/L����������ҺpH���Ԫ��ԭ�Ӱ뾶�Ĺ�ϵ����ͼ��ʾ������˵����ȷ����

A. �����Ӱ뾶��X>Y>Z>W
B. X��Y������������Ӧ��ˮ����ǡ���к�ʱ����Һ������
C. ��̬�⻯����ȶ��ԣ�Z>W>Y
D. YԪ�ش���ͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[ʵ�黯ѧ]
���������ƣ�Na2S2O5���dz��õĿ����������ڿ����С�����ʱ���ֽ⡣ʵ�����Ʊ�����Na2S2O5�ķ������ڲ��Ͻ����£����Ʒ�Ӧ�¶���40�����ң���Na2CO3��������Һ��ͨ��SO2��ʵ��װ������ͼ��ʾ��

����ҺpHԼΪ4ʱ��ֹͣ��Ӧ����20�����Ҿ��ýᾧ������Na2S2O5�Ļ�ѧ����ʽΪ
2NaHSO3===Na2S2O5+H2O
��1��SO2��Na2CO3��Һ��Ӧ����NaHSO3��CO2�������ӷ���ʽΪ____________________��
��2��װ��Y��������______________________________��
��3����������ķ�ӦҺ����ѹ���ˡ�ϴ�ӡ�25����30������ɻ��Na2S2O5���塣
����ɼ�ѹ����װ�õ���Ҫ�����Dz���©����________________�ͳ����á�
�������ñ���SO2ˮ��Һ����ˮ�Ҵ�ϴ��Na2S2O5���塣�ñ���SO2ˮ��Һϴ�ӵ�Ŀ����______��
��4��ʵ���Ƶõ�Na2S2O5�����к���һ������Na2SO3��Na2SO4������ܵ�ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һ�ֹ�ҵ��������Ҫ�ɷ�ΪMgCO3��Mg2SiO4������Fe��Al�������Ϊԭ���Ʊ�MgCO3��3H2O��ʵ��������£�

��1�����ܹ�������Ҫ��Ӧ���Ȼ�ѧ����ʽΪ
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ��H=��50.4 kJ��mol-1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ��H=��225.4 kJ��mol-1
��������ȵ�Ŀ����______������H2SO4���˹���̫���ԭ����_______��
��2������H2O2����ʱ������Ӧ�����ӷ���ʽΪ___________��
��3������ͼ��ʾ��ʵ��װ�ý�����ȡ��Һ���Գ�ȥ��Һ�е�Fe3+��

��ʵ��װ��ͼ������A������Ϊ_______��
��ΪʹFe3+�����ܶ�ش�ˮ��ת�����л��࣬��ȡ�IJ�������װ��ˮ��Һ������A�м���һ�������л���ȡ����______�����á���Һ�����ظ���Ρ�
��4���벹����������ȡ��õ���ˮ��Һ�Ʊ�MgCO3��3H2O��ʵ�鷽�����߽��������Һ�еμӰ�ˮ��______�����ˡ���ˮϴ�ӹ���2��3�Σ���50���¸���õ�MgCO3��3H2O��
[��֪����Һ��pH=8.5ʱMg(OH)2��ʼ������pH=5.0ʱAl(OH)3������ȫ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥˮ�������ˮú����Ҫ��H2��CO��CO2��������H2S��CH4��������ȥH2S�ɲ��ô���Ǵ�ת����������CH4ת����CO���õ�CO��CO2��H2�Ļ�����壬������ĺϳɼ״�ԭ������
��1����ˮú������Ҫ��ѧ��Ӧ����ʽΪ��C(s)+H2O(g) ![]() CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
�� �˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ________��
�� ����������̼��ת���ʵĴ�ʩ��________ ��
A������C��s�� B������H2O��g�� C�������¶� D������ѹǿ
��2����CH4ת����CO����ҵ�ϳ����ô�ת���������䷴Ӧԭ��Ϊ��CH4(g) +3/2O2(g) ![]() CO(g) + 2H2O(g) ��H=��519kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ��
CO(g) + 2H2O(g) ��H=��519kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ��
��X��750��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Y��600��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Z��440��ʱ��Ч����ߣ���ʹ�淴Ӧ���ʼӿ�Լ1��106����
����������Ϣ������Ϊ��������Ӧ��ѡ������˴�����_______���X����Y����Z������ѡ���������_______��
��3���ϳ����ϳɼ״�����Ҫ��Ӧ�ǣ�2H2(g)+CO(g) ![]() CH3OH��g����H=��90.8kJ��mol��1 T��ʱ���˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10min���ø���ֵ�Ũ�����£�
CH3OH��g����H=��90.8kJ��mol��1 T��ʱ���˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10min���ø���ֵ�Ũ�����£�
���� | H2 | CO | CH3OH |
Ũ��/��mol��L-1�� | 0.2 | 0.1 | 0.4 |
�� ��ʱ����ڷ�Ӧ����v(H2)=______ mol��L��1��min��1��
�� ��ʱ�������淴Ӧ���ʵĴ�С��v��______v�����������������������
��4�����������У��ϳ���Ҫ����ѭ������Ŀ����____________��
��5���״����Ƴ�����ȼ�ϵ�أ��ܷ�ӦΪ��2CH3OH+3O2 + 4KOH=2K2CO3+6H2O�õ�ظ����ĵ缫��ӦʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2(g)��C2H4(g)��C2H5OH(1)��ȼ���ȷֱ���-285.8kJ��mol-1��-1411.0kJ��mol-1��-1366.8kJ��mol-1,����C2H4(g)��H2O(l)��Ӧ����C2H5OH(l)����HΪ( )
A. -44.2kJ��mol-1 B. +44.2kJ��mlo-1
C. -330kJ��mol-1 D. +330kJ��mlo-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com