
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用右图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
【答案】(1)加快酸溶速率;避免制备MgCO3时消耗更多的碱
(2)H2O2+2Fe2++2+=2Fe3++2H2O (3)①分液漏斗;②充分振荡
(4)至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向
上层清液中滴加Na2CO3溶液,若无沉淀生成,
【解析】
试题(1)加热可以加快化学反应速率;如果硫酸过多,则需要消耗更多的减中和硫酸,从而造成生产成本增加。(或影响Mg2+转化成MgCO3。)
(2)滤液中含有Fe2+,加入H2O2将Fe2+氧化为Fe3+,发生发应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O。
(3)①根据仪器A的构造确定其名称为分液漏斗。②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,充分振荡、静置、分液,并重复多次。
(4)根据题给信息知向溶液中加入氨水调节pH不大于8.5,不小于5.0,故由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成或至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至无沉淀生成为止,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】两种物质互为同分异构体的依据是( )
A.二者具有相似的化学性质B.二者分子式相同但分子内碳原子的结合方式不同
C.二者具有相同的空间结构D.二者具有相同的物理性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铝土矿(主要成分为Al2O3,还含有SiO2(不溶于水和酸)、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

①沉淀 A、B的成分分别是____________、____________;步骤②中的试剂a是_________;(以上均填化学式)。
②试写出步骤③中发生反应的离子方式______________、________________;
③简述检验所得滤液甲中存在Fe3+的操作方法:________________________。
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①加热酸溶过程中发生反应的化学方程式有:_______________________。
②氧化剂A可选用_________________(填编号,下同)。
A.KMnO4 B.HNO3 C.Cl2
③要得到较纯的产品,试剂B可选用____________________。
A. NaOH B. CuO C.FeO
④试剂B的作用是_______________________________。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀 C. 降低溶液的pH D. 提高溶液的pH
⑤从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)。
A. 过滤 B. 蒸发至干 C. 冷却 D. 蒸发浓缩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2 NCOONH4)是一种易分解、易水解的白色固体。其研究小组以浓氨水、干冰等为原料制备氨基甲酸铵的实验装置如图1所示,其主要反应的原理为2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<0
NH2COONH4(s) △H<0


(1)仪器1的名称是___________。仪器3中盛装的固体是___________,其作用是___________。
(2)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内浓硫酸中产生气泡,则应该___________(填“加快”“减慢”或“不改变”)产生氨气的速率。
(3)另一种制备氨基甲酸铵的反应装置(液体石蜡和CCl4均充当惰性介质)如图2所示。
①液体石蜡鼓泡瓶的作用是______________________。
②若无冰水,则氨基甲酸铵易分解生成尿素[CO(NH2)2]请写出氨基甲酸铵受热分解的化学方程式:______________________。
③当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥,可采取的方法是___________(填标号)。
A.蒸馏 B.真空微热烘干 C.高压加热烘干
(4)制得的氨基甲酸铵中可能含有碳酸氢铵、碳酸铵中的一种或两种杂质(不考虑氨基甲酸铵与水的反应)。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解 | 得到无色溶液 |
步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,则证明固体中不含碳酸铵 |
步骤3:向试管中继续加入___________ | ___________,则证明固体中含有碳酸氢铵 |
②根据①的结论。取15.8g氨基甲酸铵样品,用足量氧氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97g。则样品中氨基甲酸铵的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳总结是学习化学的一种方法。
(1)甲同学发现A、B、C三种物质有如图l所示的相互反应关系,“—”表示能反应(部分反应物、生成物以及反应条件省略,下同)。己知A是常见金属,人体缺乏组成A的元素易患贫血症;B胃酸的主要成分;B与C反应产生不溶于稀硝酸的白色沉淀,则A是__(填化学式(下同),C是___。请写出下列反应的化学方程式:A与B__;B与C____。

(2)乙同学发现X、Y、Z三种物质有如图2所示的循环转化关系“→”表示能转化。
①若X、Y、Z均为含钙化合物,X是一种常用干燥剂氯化钙,Y俗称熟石灰。则X的化学式为___;请写出Y→Z的反应化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。

起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1) /℃ | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 _________。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指______________温度。
(4)大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大”、“偏小”、“无影响”)。
(5)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g·℃ ) (保留两位小数)。
(6)如果用50 mL0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,则△H会_________(填“偏大”、“偏小”、“无影响”),其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在盐酸中,再加水稀释,这样操作的目的是___。
(2)通入足量SO2时,装置C中观察到的现象为_______________。
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式____________;
②检验有Fe2+生成的方法是____________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42 -,该做法不合理,理由是____________。
(4)D装置中倒置漏斗的作用是____________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有____________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A![]() C由两步反应A→B→C构成,1molA发生反应的能量曲线如图所示。下列有关叙述正确的是
C由两步反应A→B→C构成,1molA发生反应的能量曲线如图所示。下列有关叙述正确的是
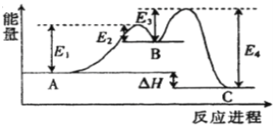
A. A![]() C的正反应为吸热反应
C的正反应为吸热反应
B. 加入催化剂会改变A与C的能量差
C. A![]() C正反应的活化能大于其逆反应的活化能
C正反应的活化能大于其逆反应的活化能
D. A![]() C的反应热△H=E1+E3-E2-E4
C的反应热△H=E1+E3-E2-E4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国成功研制出高效电催化固氮催化剂Mo2N,如图所示,在0.1mol·L-1盐酸溶液中,在一定电压下具有较高的产氨速率和稳定的电流效率。下列判断错误的是
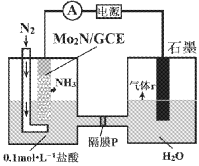
A. 石墨电极为阳极
B. P为阳离子交换膜
C. Mo2N/GCE电极区反应式为N2+6H++6e-=2NH3
D. 为提高溶液的导电性,可在石墨电极区加入适量的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com