
【题目】(1)铝土矿(主要成分为Al2O3,还含有SiO2(不溶于水和酸)、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

①沉淀 A、B的成分分别是____________、____________;步骤②中的试剂a是_________;(以上均填化学式)。
②试写出步骤③中发生反应的离子方式______________、________________;
③简述检验所得滤液甲中存在Fe3+的操作方法:________________________。
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①加热酸溶过程中发生反应的化学方程式有:_______________________。
②氧化剂A可选用_________________(填编号,下同)。
A.KMnO4 B.HNO3 C.Cl2
③要得到较纯的产品,试剂B可选用____________________。
A. NaOH B. CuO C.FeO
④试剂B的作用是_______________________________。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀 C. 降低溶液的pH D. 提高溶液的pH
⑤从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)。
A. 过滤 B. 蒸发至干 C. 冷却 D. 蒸发浓缩
【答案】SiO2 Fe(OH)3 NaOH溶液 CO2 +OH- =HCO3- CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3- 取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+ Fe + 2HCl = FeCl2 + H2↑ CuO + 2HCl =CuCl2 + H2O C B BD DCA
【解析】
(1)氧化铝是两性氧化物,既溶液强酸又溶于强碱.Fe2O3只溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸;由流程图可知,铝土矿中加入盐酸,氧化铝和氧化铁溶解,二氧化硅不溶解,沉淀A为二氧化硅;滤液乙中通入过量二氧化碳,生成碳酸氢钠和氢氧化铝沉淀,说明滤液乙中含有偏铝酸钠;由乙中含有偏铝酸钠可知,试剂a为氢氧化钠溶液,沉淀B为氢氧化铁。
(2)用含少量铁的氧化铜加盐酸溶解生成氯化铜、氯化亚铁混合液,加氧化剂把亚铁离子氧化为铁离子,再调节溶液pH,使铁离子转化为氢氧化铁沉淀,过滤得到的滤液为氯化铜溶液,蒸发浓缩、冷却结晶得到氯化铜晶体。
(1)①铝土矿中加入稀盐酸,氧化铝和氧化铁溶解,二氧化硅不溶解,沉淀A为二氧化硅;滤液乙中通入过量二氧化碳,生成碳酸氢钠和氢氧化铝沉淀,说明滤液乙为偏铝酸钠溶液;由乙为偏铝酸钠溶液可知,试剂a为氢氧化钠溶液,沉淀B为氢氧化铁,故答案为:SiO2;Fe(OH)3。
②由流程图可知,氯化铝和氯化钠与过量氢氧化钠溶液反应,滤液乙中含有过量氢氧化钠和偏铝酸钠。则步骤③为偏铝酸钠和氢氧化钠混合溶液中通入过量二氧化碳,反应生成碳酸氢钠和氢氧化铝沉淀,反应的离子方程式为:CO2 +OH- =HCO3-,CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3-,故答案为:CO2 +OH- =HCO3-,CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3-。
③检验所得滤液甲中存在Fe3+的的方法为利用Fe3+离子的检验方法进行检验,取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+,故答案为:取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+。
(2)①加热酸溶过程中发生的反应为铁和稀盐酸反应生成氯化亚铁和氢气,氧化铜和稀盐酸反应生成氯化铜和水,反应的化学方程式为:Fe + 2HCl = FeCl2 + H2↑、CuO + 2HCl =CuCl2 + H2O,故答案为:Fe + 2HCl = FeCl2 + H2↑,CuO + 2HCl =CuCl2 + H2O。
②根据题意,加入氧化剂可把Fe2+氧化为Fe3+,而没有增加新杂质,所以氧化剂为是Cl2,KMnO4和HNO3会引入杂质离子,故答案为:C。
③得到较纯的产品,需要调节pH使铁离子转化为沉淀,选择的试剂可以是CuO,而NaOH、FeO均会引入杂质离子,故答案为:B。
④试剂B为CuO,CuO与溶液中的H+反应,起到提高溶液的pH的作用,H+浓度减小,使Fe3+水解平衡向右移动,直至趋于完全生成氢氧化铁沉淀,故答案:BD。
⑤氯化铜溶液通过加热蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到氯化铜晶体,故答案为:DCA。


科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量变化的说法正确的是( )
A. Ba(OH)2·8H2O与NH4Cl的反应是放热反应
B. 少数化合反应是吸热反应
C. 燃料有足够的空气就能充分燃烧
D. H2SO4和NaOH的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在14.2g硫酸钠中:
(1)含有的Na+的数目是_________;
(2)含有的SO42-的质量是________;
(3)含氧原子的物质的量是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中一定能大量共存的是( )
A. 含有大量 Ba2+的溶液中:Cl- K+ ![]()
![]()
B. 含有大量H+的溶液中:Mg2+ Na+ ![]()
![]()
C. 含有大量OH-的溶液中:Mg2+ ![]()
![]()
![]()
D. 含有大量Na+的溶液中:H+ K+ ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如右图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
②纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
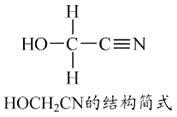
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为____________________。
(2)1 mol HCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
(5)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径:X>Y>Z>W
B. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
C. 气态氢化物的稳定性:Z>W>Y
D. Y元素存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用右图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓盐酸与次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是( )
①CO2 ②HCl ③H2O(g)
A.①②③B.②③C.①②D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com