
【题目】归纳总结是学习化学的一种方法。
(1)甲同学发现A、B、C三种物质有如图l所示的相互反应关系,“—”表示能反应(部分反应物、生成物以及反应条件省略,下同)。己知A是常见金属,人体缺乏组成A的元素易患贫血症;B胃酸的主要成分;B与C反应产生不溶于稀硝酸的白色沉淀,则A是__(填化学式(下同),C是___。请写出下列反应的化学方程式:A与B__;B与C____。

(2)乙同学发现X、Y、Z三种物质有如图2所示的循环转化关系“→”表示能转化。
①若X、Y、Z均为含钙化合物,X是一种常用干燥剂氯化钙,Y俗称熟石灰。则X的化学式为___;请写出Y→Z的反应化学方程式____。
【答案】Fe AgNO3 Fe+2HCl=FeCl2+H2↑ HCl+AgNO3=AgCl↓+HNO3 CaCl2 Ca(OH)2+CO2=CaCO3↓+H2O
【解析】
(1)A是常见金属,人体缺乏组成A的元素易患贫血症,所以A是铁,B是胃酸的主要成分,所以B盐酸,盐酸与C反应产生不溶于稀硝酸的白色沉淀,所以C是硝酸银,铁和盐酸反应生成氯化亚铁和氢气,盐酸和硝酸银反应生成白色的氯化银沉淀和硝酸,铁和硝酸银反应生成硝酸亚铁和银,推出的物质满足题中的转化关系。故A是Fe,C是AgNO3,A与B的反应是铁和盐酸反应生成氯化亚铁和氢气,化学方程式为:Fe+2HCl=FeCl2+H2↑,B与C的反应是盐酸和硝酸银反应生成氯化银沉淀和硝酸,化学方程式为:HCl+AgNO3=AgCl↓+HNO3;
(2)X、Y、Z均为含钙化合物,X是一种常用干燥剂氯化钙,化学式为CaCl2,Y俗称熟石灰,所以Y是氢氧化钙,依据X、Y、Z三种物质的转化关系可知,Z是碳酸钙,氯化钙和饱和氢氧化钠反应会生成氢氧化钙,氢氧化钙和二氧化碳反应会生成碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,推出的各种物质均满足题中的转化关系。故X的化学式为CaCl2,Y→Z的反应是氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在某密闭容器中进行如下反应:

mA(g)+nB(g)![]() pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
A. 正反应是吸热反应 B. 逆反应是放热反应
C. m+n<p+q D. m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如右图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
②纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径:X>Y>Z>W
B. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
C. 气态氢化物的稳定性:Z>W>Y
D. Y元素存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验探究小组研究320 K时N2O5的分解反应:2N2O5![]() 4NO2+O2。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是
4NO2+O2。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是
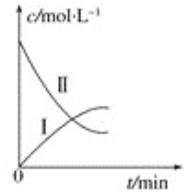
t/min | 0 | 1 | 2 | 3 | 4 |
c(N2O5)/mol/L | 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
c(O2)/mol/L | 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是N2O5的浓度变化曲线
B.曲线Ⅱ是O2的浓度变化曲线
C.N2O5的浓度越大,反应速率越快
D.升高温度对该反应速率无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用右图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子的说法正确的是
①原子是由核外电子和原子核构成的 ②原子不能再分 ③原子是化学变化中最小的粒子 ④原子的质量主要集中在原子核上
A.①②B.①③④C.①②③D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B-、C三种短周期元素的粒子具有相同的电子层结构,则关于它们的叙述正确的是
A.原子序数:C>B>AB.离子半径:B-<A+C.C是稀有气体元素的原子D.原子半径:A<B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明有关物质的性质,某学生设计了如图所示的装置。当打开活塞C,使A中液体与H中的搁板上的固体B相遇时,即有气体产生,并发现D中蜡烛慢慢熄灭;关闭C打开E时,则看到G中蜡烛燃得更亮。

(1)请写出该装置中有关仪器内盛放的物质的化学式:A___B___F_____;
(2)用化学方程式表示上述实验仪器中发生的有关反应:
H中:____;F中:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com