
| A. | Cu+HNO3(浓)→Cu(NO3)2 | |
| B. | Cu+HNO3(稀)→Cu(NO3)2 | |
| C. | Cu$→_{△}^{空气}$ CuO $\stackrel{稀硝酸}{→}$Cu(NO3)2 | |
| D. | Cu $→_{△}^{浓硫酸}$CuSO4 $\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
分析 制备硝酸铜,应尽量节省原料,且减少或杜绝污染性气体的排放,结合反应的方程式解答该题.
解答 解:A.Cu+4 HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,NO2是有毒气体,污染环境,故A错误;
B.3 Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,NO是有毒气体,污染环境,故B错误;
C.2Cu+O2=2CuO,CuO+2HNO3=Cu(NO3)2+H2O,该反应过程没有有毒气体生成,不污染环境,故C正确;
D.Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,SO2是有毒气体,污染环境,故D错误.
故选C.
点评 本题是从“绿色化学”视角考查化学知识,“绿色化学”要求设计安全的、对环境友好的合成路线,降低化学工业生成过程中对人类健康和环境的危害,减少废弃物的产生和排放.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
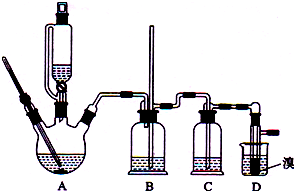
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ ClO-+H2↑;.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.
.在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ ClO-+H2↑;.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发皿加热NaCl溶液 | |
| B. | 不慎将汞滴落到桌面上,应立即用较多的水冲洗 | |
| C. | 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| D. | 用瓷坩埚熔化氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同时间内消耗n mol N2的同时消耗3n mol H2 | |
| B. | H2的体积分数不再发生变化 | |
| C. | 容器内原子总数不再发生变化 | |
| D. | 容器内气体的密度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑧ | B. | ①②③⑤ | C. | ②③④⑥ | D. | ②③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将10.6g Na2CO3溶于100mL水中 | |
| B. | 将57.2g Na2CO3•10H2O溶于少量水中,再用水稀释至200mL | |
| C. | 将20 mL 5.0mol/L Na2CO3溶液用水稀释至100mL | |
| D. | 将21.2gNa2CO3•10H2O溶于200mL水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com