
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.1molNa2O2固体中含离子总数是3NA
B.0.1molMg 2+含有的核外电子数为0.2NA
C.常温下,1 L pH=13 的Ba(OH )2溶液中所含 OH-数目为 0.2NA
D.6.4 g Cu与足量硫充分反应,转移电子数为0.2NA
【答案】A
【解析】
A.过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠由2mol钠离子和1mol过氧根构成,即含3mol离子,即3NA个,故A正确;
B.1个镁原子核外有12个电子,1个Mg2+核外有10个电子,则0.1mlMg2+含有的核外电子数为1mol,即NA个,故B错误;
C.常温下,1 L pH=13的Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,含有氢氧根离子个数为:0.1mol/L×1L×NA=0.1NA,故C错误;
D.6.4g铜的物质的量为0.1mol,而铜和硫反应方程式为2Cu+S![]() Cu2S,Cu由0价变+1价,0.1mol铜转移0.1NA个电子,故D错误;
Cu2S,Cu由0价变+1价,0.1mol铜转移0.1NA个电子,故D错误;
答案为A。


科目:高中化学 来源: 题型:
【题目】锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.产生气泡的速度甲比乙慢
D.两烧杯中溶液的 H+的浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
化学键 | 键能/(kJ·mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】久置的FeSO4溶液变黄,一般认为是被氧化为的缘故。回答下列问题:
(1)久置的FeSO4溶液中Fe3+的检验:
向久置的FeSO4溶液中加入KSCN的现象为:______________________________,向含有Fe3+久置的FeSO4溶液中加入少量KI—淀粉溶液,发现溶液变蓝,反应的离子方程式:________________________________________。
(2)除去久置FeSO4溶液中Fe3+:
在溶液中加入少量铁粉,可以观察到的现象为______________________;反应的离子方程式为:_____________________________,不能用铜粉作为除去FeSO4溶液中Fe3+试剂的原因:__________________________。
(3)查阅资料:溶液中Fe2+的氧化过程分为两步,首先是Fe2+水解为Fe(OH)2,接着水解产物被O2氧化。
写出Fe(OH)2在空气中被氧化的化学方程式:________________________________,其现象为:__________________________________________________
(4)某研究小组研究常温下不同pH对Fe2+被O2氧化的影响,如图。结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响:___________________________________。
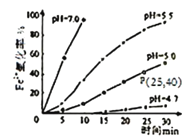
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列装置可测量一定质量的钢材中的含碳量(部分加持装置已略去)。下列有关判断正确的是( )

A. 实验时,先打开K1、K2,关闭K3,从a处通入N2,目的是排出装置中的O2
B. 点燃酒精灯前,需要打开K1、关闭K2,打开K3、K1起到平衡气压的作用
C. 装置②中的酸性KMnO4溶液吸收SO2,装置③盛有浓硫酸,起到干燥作用
D. 实验前后需称取装置④和装置⑤的质量,才能准确地测得钢材的含碳量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选用的仪器和药品能达到实验目的的是
A | B | C | D |
|
|
|
|
制取NaHCO3 | 检验反应产生的SO2 | 蒸馏时的接收装置 | 制取NO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列反应的化学方程式。
(1)铁做催化剂,苯与溴单质反应_________________;
(2)CH3CH2CH2OH发生消去反应生成丙烯_____________;
(3)苯乙烯(![]() )在适当引发剂作用下生成聚苯乙烯_________________________。
)在适当引发剂作用下生成聚苯乙烯_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是与乙醇有关的两个实验,
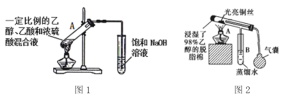
(1)图1试管A中的反应方程式为______________________________。请指出图1中两处明显的错误①________________________________;②_________________________________。
(2)点燃图2中酒精灯,反复挤压气囊,向图2装置中鼓入空气,铜丝反复出现由红变黑又由黑变红的现象,请写出相应的化学反应方程式____________________、____________________在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是________(填“吸热”或“放热”)反应。
(3)图2反应进行一段时间后,若试管B中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________(填名称)。要除去该物质,可先在混合液中加入_____(填写字母),
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________________(填实验操作名称)即可除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com