
����Ŀ�����Ļ����������������й㷺���ڡ�
(1)���Ȱ���NH2Cl���ĵ���ʽΪ________����ͨ����ӦNH3(g)��Cl2(g)=NH2Cl(g)��HCl(g)�Ʊ��Ȱ�����֪���ֻ�ѧ���ļ������ұ���ʾ���ٶ���ͬ������ͬ�ֻ�ѧ���ļ���һ��������������Ӧ�Ħ�H=_________��
��ѧ�� | ����/(kJ��mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
��NH2Cl��ˮ��Ӧ����ǿ�����Ե����ʣ�������Ч�������������÷�Ӧ�Ļ�ѧ����ʽΪ________��
(2)�ý�̿��ԭNO�ķ�ӦΪ��2NO(g)+C(s)![]() N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ��£���Ӧ�¶ȷֱ�Ϊ400�桢400�桢T�棩�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��
N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ��£���Ӧ�¶ȷֱ�Ϊ400�桢400�桢T�棩�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)����������/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)����������/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)����������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�ٸ÷�ӦΪ____________������ȡ������ȡ�����Ӧ��
����������200min�ﵽƽ��״̬����0��200min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(NO)=_________��
(3)�ý�̿��ԭNO2�ķ�ӦΪ��2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��

��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A)_____Kc(B)�������������=������
��A��B��C������NO2��ת������ߵ���______���A����B����C�����㡣
�ۼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=______��Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�����������
���𰸡� ![]() +11.3kJ/mol-1 NH2Cl��H2O
+11.3kJ/mol-1 NH2Cl��H2O![]() NH3��HClO��NH2Cl��2H2O
NH3��HClO��NH2Cl��2H2O![]() NH3H2O��HClO ���� 0.003mol��L-1��min-1 = A 2MPa
NH3H2O��HClO ���� 0.003mol��L-1��min-1 = A 2MPa
��������(1)��1���ٵ�ԭ���������5�����ӣ���ԭ���������7�����ӣ���ԭ�������1�����ӣ�����ԭ�Ӽ��Թ��ۼ���ϣ��Ȱ���NH2Cl���ĵ���ʽΪ![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ����ӦΪNH3(g)��Cl2(g)=NH2Cl(g)��HCl(g)����H=��Ӧ���ܼ���-�������ܼ���=3��391.3+243-2��391.3-191.2-431.8=+11.3kJ/mol-1����ȷ�𰸣�+11.3kJ/mol-1��
����ӦΪNH3(g)��Cl2(g)=NH2Cl(g)��HCl(g)����H=��Ӧ���ܼ���-�������ܼ���=3��391.3+243-2��391.3-191.2-431.8=+11.3kJ/mol-1����ȷ�𰸣�+11.3kJ/mol-1��
�����������ǿ�����ԡ������������õ��Ǵ����ᣬ��Ԫ����-1������Ϊ+1�ۣ���Ԫ����-2�ۻ�ԭ��-3�ۣ����ɰ�������ȷ�𰸣�NH2Cl��H2O![]() NH3��HClO��NH2Cl��2H2O
NH3��HClO��NH2Cl��2H2O![]() NH3H2O��HClO��
NH3H2O��HClO��
��2���ٴӼױ�������Ӧ���̿����������n(NO)һ�������DZ������ȴ�ƽ�⣬˵�������¶ȱȼߣ�����n(NO)ʣ�����ȼ࣬˵�������¶ȣ�ƽ�����ƣ��÷�Ӧ����ӦΪ���ȷ�Ӧ����ȷ�𰸣����ȡ�
�� �ݻ�Ϊ1L�ļ��У� 2NO(g)+C(s)![]() N2(g)+CO2(g)��
N2(g)+CO2(g)��
��ʼ�� 2 0 0
�仯�� 1.2 0.6 0.6
ƽ���� 0.8 0.6 0.6
ƽ�ⳣ��=c(N2)��c(CO2)/ c2(NO)=0.6��0.6/0.82=9/16;����������Ӧ�����¶���ͬ������ƽ�ⳣ����ͬ��
�ݻ�Ϊ1L���������У���NO�ı仯��Ϊxmol��
2NO(g)+C(s)![]() N2(g)+CO2(g)��
N2(g)+CO2(g)��
��ʼ�� 1 0 0
�仯�� x 0.5x 0.5x
ƽ���� 1- x 0.5x 0.5x
ƽ�ⳣ��=c(N2)��c(CO2)/ c2(NO)= 0.5x��0.5x/(1- x)2=9/16,��֮��x=0.6mol��0��200min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(NO)= 0.6��1��200= 0.003mol��L-1��min-1����ȷ�𰸣�0.003mol��L-1��min-1��
(3) ��ƽ�ⳣ��ֻ���¶��йأ������¶Ȳ��䣬ƽ�ⳣ�����䣬 Kc(A)= Kc(B)����ȷ�𰸣� =��
������ѹǿ��ƽ�����ƣ�NO2��ת���ʽ��ͣ�����A��B��C������ѹǿ��СΪA�㣬�õ�ת���������ȷ�𰸣�A��
���ɽ�̿��ԭNO2�ķ�ӦΪ��2NO2(g)+2C(s)![]() N2(g)+2CO2(g)���ں��������£�1molNO2������C������Ӧ��C��ʱ��NO2��CO2�����ʵ���Ũ����ȣ���֪��ʱ��Ӧ��ϵ��n(NO2)=0.5mol��n(N2)=0.25mol��n(CO2)=0.5mol�����������ʵķ�ѹ�ֱ�Ϊ��P(NO2)=P(CO2)=10MPa��
N2(g)+2CO2(g)���ں��������£�1molNO2������C������Ӧ��C��ʱ��NO2��CO2�����ʵ���Ũ����ȣ���֪��ʱ��Ӧ��ϵ��n(NO2)=0.5mol��n(N2)=0.25mol��n(CO2)=0.5mol�����������ʵķ�ѹ�ֱ�Ϊ��P(NO2)=P(CO2)=10MPa��![]() =4��P(N2)=2MPa��C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)= 2MPa��42MPa/42MPa=2 MPa����ȷ�𰸣�2MPa��
=4��P(N2)=2MPa��C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)= 2MPa��42MPa/42MPa=2 MPa����ȷ�𰸣�2MPa��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����RԪ��ԭ�ӵ�������ΪA��Rm-�ĺ��������Ϊx����w g Rm-�������ӵ����ʵ���Ϊ�� ��
A.(A-x+m) molB.(A-x-m) mol
C.![]() (A-x+m) molD.
(A-x+m) molD.![]() (A-x-m) mol
(A-x-m) mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ��п�ɳ���طŵ�ʱ�缫��������ת����ʾ��ͼ�����ʹ��KOH��K2Zn(OH)4Ϊ�������Һ,���й��ڸõ��˵����ȷ����

A. �ŵ�ʱ��Һ�е�K+����
B. ���ʱ����������pH������
C. �ŵ�ʱ������ӦΪH++NiOOH+e-=Ni(OH)2
D. ��������ÿ����6.5g,��Һ��������6.3g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��������ͼ�ش��������⡣

��1����ԭ������·�е�������п_______ͭ����������������������
��2����ԭ�����_______�缫��д���缫�������ƣ�������ɫ���ݣ� д���õ缫��Ӧʽ��_______���õ缫���� _______��Ӧ(����������������ԭ��)�� ����·��ͨ�� 0.2mol ����ʱ���õ缫�ϲ����������ڱ�״���µ����Ϊ_____L��
��3��һ��ʱ����ձ�����Һ�� pH______������������������С������
II����������������ɴ���ʹ�õ�����ȼ�ϵ����һ�����͵ĵ�أ��乹����ͼ��ʾ������ �缫���ɶ��̼�Ƴɣ�ͨ��������ɿ�϶�����������ӵ缫����ų���
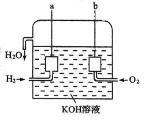
��1��a ����_____���缫��Ӧʽ��_____��
��2��b ����_____���缫��Ӧʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(N2H4)�ڲ�ͬ�����·ֽ���ﲻͬ��200 ��ʱ��Cu����ֽ�Ļ�����ͼ����ʾ����֪200 ��ʱ��
��Ӧ��3N2H4(g)===N2(g)��4NH3(g) ��H1����32.9 kJ��mol��1
��Ӧ��N2H4(g)��H2(g)===2NH3(g) ��H2����41.8 kJ��mol��1
����˵���в���ȷ���� (�� ��)
A.ͼ��ʾ���̢١��ڶ��Ƿ��ȷ�Ӧ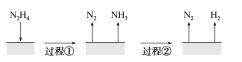
B.��Ӧ�����������ʾ��ͼ��ͼ��ʾ
C.����3 mol N2H4(g)�еĻ�ѧ�����յ�����С���γ�1 mol N2(g)��4 mol NH3(g)�еĻ�ѧ���ͷŵ�����
D.200 ��ʱ���·ֽ����ɵ������������Ȼ�ѧ����ʽΪN2H4(g)===N2(g)��2H2(g)����H����50.7 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�֣���ͼ��ʵ�������Ʊ��������֤�������ʵ�װ��ͼ��

��1������a��������_________________________��
��2��������ͼװ���Ʊ������������������
��Բ����ƿ�ڷ�����Ӧ�����ӷ���ʽΪ________________________________________��
��װ��B����ҺΪ________________���ձ�E����Һ������Ϊ_______________________��
��3������ͼװ��֤��SO2����Ư���ԡ���ԭ�Լ����������к���CO2��
Բ����ƿ�ڼ���̼��a�м���Ũ���ᣬB��D�о�Ϊ����Ʒ����Һ��C��Ϊ�������Ը��������Һ��E��Ϊ����ʯ��ˮ��
��֤��SO2����Ư���Ե�װ����_______________��������______________________��
��֤��SO2���л�ԭ�Ե�������_____________________________________________��
��֤�����������к���CO2��������_________________________________________��
��Dװ�õ�������________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ܱ������м���0.15 mol��L��1 A��0.05 mol��L��1 C��һ������B�������塣һ�������·�����Ӧ��������Ũ����ʱ��仯��ͼ�м�ͼ��ʾ[t0��t1ʱc(B)δ������t1ʱc(B)����0.05 mol��L��1]����ͼΪt2ʱ�̺�ı䷴Ӧ������ƽ����ϵ�������淴Ӧ������ʱ��仯�������
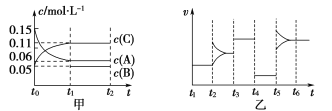
��1����t4ʱ�ı������Ϊ��Сѹǿ����B����ʼ���ʵ���Ũ��Ϊ___mol��L��1��
��2����t5ʱ�ı�����������£���ʱv(��)>v(��)����A�����ʵ�������0.03 molʱ�������������Ƚ�������Ϊa kJ��д����Ӧ���Ȼ�ѧ����ʽ��___________________________________��
��3��t3ʱ�ı��ijһ��Ӧ����������________(����ĸ)��
a��ʹ�ô����� b������ѹǿ�� c������Ӧ��Ũ��
��4���ں��º�ѹ��ͨ��������壬v(��)________v(��)(����>������������<��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ�������й�������ȷ���ǣ��� ����
A.1molNa2O2���������������3NA
B.0.1molMg 2+���еĺ��������Ϊ0.2NA
C.�����£�1 L pH��13 ��Ba��OH ��2��Һ������ OH����ĿΪ 0.2NA
D.6.4 g Cu���������ַ�Ӧ��ת�Ƶ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ĵ��ѽ�ɰ��������ַ�ʽ���У�C4H10��C2H6+C2H4�� C4H10��CH4+C3H6��ij��ѧ��ȤС���ͬѧΪ̽�������ѽ�����CH4��C2H6�ı�����ϵ�������ͼ��ʾʵ�飺
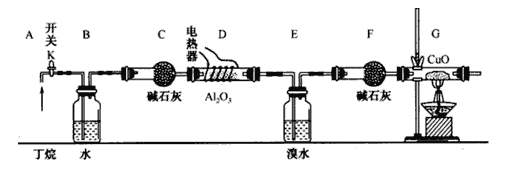
ע��CuO�ܽ���������CO2��H2O��A12O3�Ƕ����ѽ�Ĵ�����G����װ����ʡ�ԡ���ͼ���Ӻ�װ�ú�(���ּг�װ������ȥ)������е�ʵ������У�
�ٸ�D��Gװ�ü��ȣ��ڼ������װ�õ������ԣ����ž�װ���еĿ�����
��1���������������Ⱥ�˳��������____________��
��2����Ҫ˵����������ž��ķ�����_______________________________________________��
��3��Bװ�������������__________________________________________��
��4�����趡����ȫ�ѽ⣬������װ���е���������ȫ��Ӧ����(E��F)װ�õ��������ȷ�Ӧǰ������ 1.82g, Gװ���й������������� 4.l6g��������ѽ������n(CH4)��n(C2H6)=_____________��
��5������Eװ���еĻ�����ٰ���������ʵ�飺

�ٷ������I�����������I_____________�� II_______________��
��Na2SO3��Һ�������ǣ������ӷ���ʽ��ʾ��__________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com