
����Ŀ����10�֣���ͼ��ʵ�������Ʊ��������֤�������ʵ�װ��ͼ��

��1������a��������_________________________��
��2��������ͼװ���Ʊ������������������
��Բ����ƿ�ڷ�����Ӧ�����ӷ���ʽΪ________________________________________��
��װ��B����ҺΪ________________���ձ�E����Һ������Ϊ_______________________��
��3������ͼװ��֤��SO2����Ư���ԡ���ԭ�Լ����������к���CO2��
Բ����ƿ�ڼ���̼��a�м���Ũ���ᣬB��D�о�Ϊ����Ʒ����Һ��C��Ϊ�������Ը��������Һ��E��Ϊ����ʯ��ˮ��
��֤��SO2����Ư���Ե�װ����_______________��������______________________��
��֤��SO2���л�ԭ�Ե�������_____________________________________________��
��֤�����������к���CO2��������_________________________________________��
��Dװ�õ�������________________________________________��
���𰸡���10�֣���1����Һ©��
��2����4H++2Cl-+MnO2![]() 2H2O + Cl2��+Mn2+
2H2O + Cl2��+Mn2+
������ʳ��ˮ ����������ֹ��Ⱦ
��3����B Ʒ����ɫ��C�е�KMnO4��Һ��ɫ
��D��Ʒ�첻��ɫ��E��ʯ��ˮ�������������������Ƿ����
��������
������1��������a��ͼ�ο�֪a�Ƿ�Һ©����
��2����Բ����ƿ�ڷ����ķ�Ӧ��ʵ������ȡ�����ķ�Ӧ�����ӷ���ʽΪ4H++2Cl-+MnO2![]() 2H2O + Cl2��+Mn2+
2H2O + Cl2��+Mn2+
��װ��B��Ŀ���dz�ȥ�����е�HCl������B����ҺΪ����ʳ��ˮ���ձ�E��������β������������ʣ�����������ֹ��Ⱦ��
��3��B�е�Ʒ����Һ��֤���������Ư���ԣ�C����������֤��������Ļ�ԭ�ԣ�D�е�Ʒ��������֤Ʒ���Ƿ������E�е�ʯ��ˮ��֤������̼�Ĵ��ڡ��������������ʹƷ����Һ��ɫ������֤��SO2����Ư���Ե�װ����B��B�е�Ʒ����ɫ����֤����
������������л�ԭ�ԣ���ʹ���Ը��������Һ��ɫ������֤��SO2���л�ԭ�Ե�������C�е�KMnO4��Һ��ɫ
������������E֮ǰӦ��ȥ������֤�����������к���CO2��������D��Ʒ�첻��ɫ��E��ʯ��ˮ����ǣ�
��Dװ�õ������Ǽ�����������Ƿ������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ�����߷ֱ��ʾ��ͬ�¶��£�ѹǿΪP1��P2�����·������淴Ӧ��mX(g)+nY(g)![]() 2Z(g)+W(s)�Ĺ��̡�����˵������ȷ���ǣ� ��
2Z(g)+W(s)�Ĺ��̡�����˵������ȷ���ǣ� ��
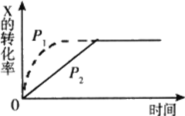
A.P1>P2B.m+n=2
C.m+n=3D.P1��P2��ƽ�ⳣ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������1 mol��ѧ��������������£�
��ѧ�� | N��N | O=O | N��N | N��H |
����(kJ) | 154 | 500 | 942 | a |
���ȼ����(H2N��NH2)���йػ�ѧ��Ӧ�������仯��ͼ��ʾ��������˵���������

A��N2��O2�ȶ�
B��N2H4(g)��O2(g)=N2(g)��2H2O(g) ��H����534 kJ��mol-1
C�����е�a��194
D��ͼ�е���H3����2218 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����Ϊ̽������Ũ����![]() ����
����![]() �ķ�Ӧ������֤
�ķ�Ӧ������֤![]() �����ʣ������ͼ��ʾװ�ý���ʵ�飬����˵������ȷ���ǣ���
�����ʣ������ͼ��ʾװ�ý���ʵ�飬����˵������ȷ���ǣ���

A.װ��B������![]() ��Һ����ɫ�������˶�������Ļ�ԭ��
��Һ����ɫ�������˶�������Ļ�ԭ��
B.ʵ����������װ��A����Һ�еμ�KSCN��Һ�Լ������ɵ�![]()
C.װ��D��Ʒ����Һ��ɫ������֤![]() ��Ư����
��Ư����
D.ʵ��ʱ������a����Ũ�����У��ɷ�ֹװ��B�е���Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ����������������й㷺���ڡ�
(1)���Ȱ���NH2Cl���ĵ���ʽΪ________����ͨ����ӦNH3(g)��Cl2(g)=NH2Cl(g)��HCl(g)�Ʊ��Ȱ�����֪���ֻ�ѧ���ļ������ұ���ʾ���ٶ���ͬ������ͬ�ֻ�ѧ���ļ���һ��������������Ӧ�Ħ�H=_________��
��ѧ�� | ����/(kJ��mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
��NH2Cl��ˮ��Ӧ����ǿ�����Ե����ʣ�������Ч�������������÷�Ӧ�Ļ�ѧ����ʽΪ________��
(2)�ý�̿��ԭNO�ķ�ӦΪ��2NO(g)+C(s)![]() N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ��£���Ӧ�¶ȷֱ�Ϊ400�桢400�桢T�棩�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��
N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ��£���Ӧ�¶ȷֱ�Ϊ400�桢400�桢T�棩�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)����������/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)����������/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)����������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�ٸ÷�ӦΪ____________������ȡ������ȡ�����Ӧ��
����������200min�ﵽƽ��״̬����0��200min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(NO)=_________��
(3)�ý�̿��ԭNO2�ķ�ӦΪ��2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��

��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A)_____Kc(B)�������������=������
��A��B��C������NO2��ת������ߵ���______���A����B����C�����㡣
�ۼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=______��Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������˵��2HI��g��H2��g��+I2��g���Ѵ�ƽ��״̬����__________
�ٵ�λʱ��������nmolH2��ͬʱ������nmolHI��
��1��H��H�����ѵ�ͬʱ��2��H��I�����ѣ�
�ۻ�����аٷ����ΪHI%=I2%��
�ܷ�Ӧ����v��H2��=v��I2��=![]() v��HI��ʱ��
v��HI��ʱ��
�ݻ��������c��HI����c��H2����c��I2��=2��1��1ʱ��
���¶Ⱥ����һ��ʱ��ijһ������Ũ�Ȳ��ٱ仯��
���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯��
������һ������������ƽ�������������ٱ仯��
���¶Ⱥ����һ��ʱ������������ɫ���ٱ仯��
���¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٱ仯��
�����ޡ����˵������˵��2NO2N2O4�ﵽƽ��״̬����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ�FeSO4��Һ��ƣ�һ����Ϊ�DZ�����Ϊ��Ե�ʡ��ش��������⣺
(1)���õ�FeSO4��Һ��Fe3+�ļ��飺
����õ�FeSO4��Һ�м���KSCN������Ϊ��______________________________������Fe3+���õ�FeSO4��Һ�м�������KI��������Һ��������Һ��������Ӧ�����ӷ���ʽ��________________________________________��
(2)��ȥ����FeSO4��Һ��Fe3+��
����Һ�м����������ۣ����Թ۲쵽������Ϊ______________________����Ӧ�����ӷ���ʽΪ��_____________________________��������ͭ����Ϊ��ȥFeSO4��Һ��Fe3+�Լ���ԭ��__________________________��
(3)�������ϣ���Һ��Fe2+���������̷�Ϊ������������Fe2+ˮ��ΪFe(OH)2������ˮ����ﱻO2������
д��Fe(OH)2�ڿ����б������Ļ�ѧ����ʽ��________________________________��������Ϊ��__________________________________________________
(4)ij�о�С���о������²�ͬpH��Fe2+��O2������Ӱ�죬��ͼ�����ͼ������ͬpH��Fe2+��O2�����ķ�Ӧ������������Ӱ�죺___________________________________��
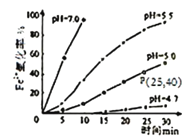
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ�õ�������ҩƷ�ܴﵽʵ��Ŀ�ĵ���
A | B | C | D |
|
|
|
|
��ȡNaHCO3 | ���鷴Ӧ������SO2 | ����ʱ�Ľ���װ�� | ��ȡNO |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������װ�ú������ܴﵽʵ��Ŀ����![]()
A. 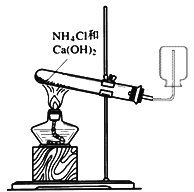 ��ȡ���ռ�����
��ȡ���ռ�����
B. 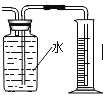 �ռ����ⶨ���������
�ռ����ⶨ���������
C. 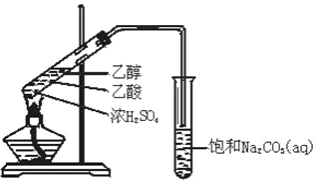 ����������
����������
D. 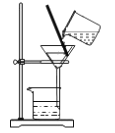 �ñ��������ˮ�еĵⵥ��
�ñ��������ˮ�еĵⵥ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com