
【题目】下列情况中说明2HI(g)H2(g)+I2(g)已达平衡状态的是__________
①单位时间内生成nmolH2的同时,生成nmolHI;
②1个H﹣H键断裂的同时有2个H﹣I键断裂;
③混合气中百分组成为HI%=I2%;
④反应速率v(H2)=v(I2)=![]() v(HI)时;
v(HI)时;
⑤混合气体中c(HI):c(H2):c(I2)=2:1:1时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
上述⑥~⑩的说法中能说明2NO2N2O4达到平衡状态的是___________。
【答案】②⑥⑨ ⑥⑦⑧⑨⑩
【解析】
①单位时间内生成nmolH2的同时,生成nmolHI,变化量之比不等于计量数之比,故错误;
②1个H﹣H键断裂,等效于2个H﹣I键形成,同时有2个H﹣I键断裂,正逆反应速率相等,达平衡状态,故正确;
③各组分百分含量不变是平衡状态的特征,而平衡时混合气中百分组成可能为HI%=I2%,与各物质的初始浓度及转化率有关,故错误;
④只要反应发生就有反应速率v(H2)=v(I2)=![]() v(HI),故错误;
v(HI),故错误;
⑤当体系达平衡状态时,混合气体中c(HI):c(H2):c(I2)可能是2:1:1,也可能不是,与各物质的初始浓度及转化率有关,故错误;
⑥温度和体积一定时,某一生成物浓度不再变化,正逆速率相等达平衡状态,故正确;
⑦温度和体积一定时,两边计量数相等,容器内压强始终不再变化,故错误;
⑧条件一定,两边计量数相等,混合气体的平均分子质量始终不再变化,故错误;
⑨温度和体积一定时,混合气体的颜色不再变化,说明碘蒸气的浓度不变,反应达平衡状态,故正确;
⑩温度和压强一定时,两边气体的计量数相等,体积是一个定值,混合气体的密度始终不再变化,故错误;故选②⑥⑨。
上述⑥~⑩的说法中能说明2NO2N2O4达到平衡状态的是:
⑥温度和体积一定时,某一生成物浓度不再变化,正逆速率相等达平衡状态,故正确;
⑦温度和体积一定时,两边计量数不相等,容器内压强不再变化,说明反应达平衡状态,故正确;
⑧条件一定,混合气体的平均分子质量不再变化,说明物质的量不变,反应达平衡状态,故正确;
⑨温度和体积一定时,混合气体的颜色不再变化,说明二氧化氮的浓度不变,反应达平衡状态,故正确;
⑩温度和压强一定时,混合气体的密度不再变化,说明气体的物质的量不变,反应达平衡状态,故正确;
故选⑥⑦⑧⑨⑩。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对于反应2NO2(g)![]() N2O4(g) △H<0,增大压强(体积迅速减小),下列说法正确的是( )
N2O4(g) △H<0,增大压强(体积迅速减小),下列说法正确的是( )
A.平衡逆向移动
B.混合气体颜色比原来深
C.混合气体颜色比原来浅
D.混合气体的平均相对分子质量变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)下图是实验室中制备气体或验证气体性质的装置图。

(1)仪器a的名称是_________________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为________________________________________;
②装置B中溶液为________________,烧杯E中溶液的作用为_______________________。
(3)利用图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是_______________,现象是______________________;
②证明SO2具有还原性的现象是_____________________________________________;
③证明生成气体中含有CO2的现象是_________________________________________;
④D装置的作用是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法正确的是![]()
![]()
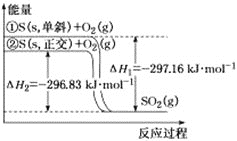
A.![]() ,单斜
,单斜![]() ,正交
,正交![]()
B.等质量的单斜硫和正交硫分别完全燃烧,前者放出的热量更多
C.相同物质的量的正交硫比单斜硫所含有的能量高,正交硫比单斜硫稳定
D.![]() 表示断裂
表示断裂![]() 中的共价键所吸收的能量比形成
中的共价键所吸收的能量比形成![]() 中的共价键所放出的能量少
中的共价键所放出的能量少 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
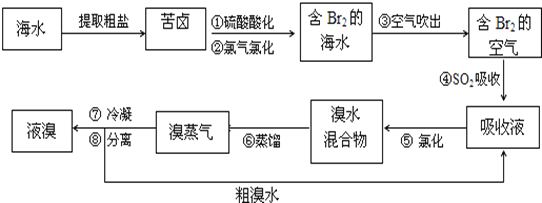
(1)步骤①中用硫酸酸化可提高Cl2的利用率,理由是__________________________。
(2)步骤②反应的离子方程式为__________________________;步骤④利用了SO2的还原性,反应的离子方程式为__________________________。
(3)步骤⑥的蒸馏过程中,温度应控制在8090℃。温度过高或过低都不利于生产,请解释原因______________________。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是__________________。
(5)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下反应:A2(g)+3 B2(g)![]() 2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
A.Q2 = 2 Q1 B.2Q1 < Q2
C.Q1 < Q2 < 92.4 kJ D.Q1 = Q2 < 92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为___________。利用喷雾干燥法脱硫工艺也是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下吸收液中c(Ca2+)一直保持为0.50 mol·L-1,已知KSP(CaSO3)=1.4×10-7,则吸收后溶液中![]() 的浓度______________________。
的浓度______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示:
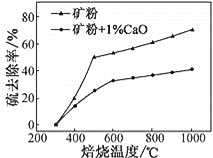
已知:多数金属硫酸盐的分解温度都高于600℃;硫去除率=(1![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于____________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是________________。
(3)向“过滤”得到的滤液中通入过量CO2,含铝粒子反应的离子方程式_________
(4) “过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com