
����Ŀ���Ը���������(��Ҫ�ɷ�ΪAl2O3��Fe2O3��SiO2������FeS2�ͽ���������)Ϊԭ�ϣ����������������Fe3O4�IJ��ֹ����������£�

(1)���չ��̾������SO2����NaOH��Һ���չ���SO2�����ӷ���ʽΪ___________�������������������Ҳ�dz�ȥSO2�ij����������Ƚ���SO2�ķ�������ˮ�����ñ���ʯ�ҽ����ա����¶�������Һ��c(Ca2+)һֱ����Ϊ0.50 mol��L-1����֪KSP(CaSO3)=1.4��10-7�������պ���Һ��![]() ��Ũ��______________________��
��Ũ��______________________��
(2)����1%CaO�Ͳ�����CaO�Ŀ�۱��գ�����ȥ�������¶ȱ仯������ͼ��ʾ��
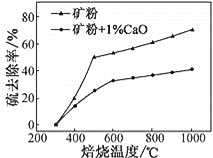
��֪���������������εķֽ��¶ȶ�����600�棻��ȥ����=(1![]() )��100%
)��100%
�ٲ�����CaO�Ŀ���ڵ���500 �決��ʱ��ȥ������Ԫ����Ҫ��Դ��____________��
��700�決��ʱ������1%CaO�Ŀ����ȥ���ʱȲ�����CaO�Ŀ����ȥ���ʵͣ�����Ҫԭ����________________��
(3)���ˡ��õ�����Һ��ͨ�����CO2���������ӷ�Ӧ�����ӷ���ʽ_________
(4) �����ˡ��õ��������к�������Fe2O3��Fe2O3��FeS2��Ϻ���ȱ�������±�������Fe3O4��SO2����������ȫ��Ӧ���ĵ�n(FeS2)��n(Fe2O3)=__________________��
���𰸡�SO2+OH=HSO3 2.8��10-7mo1/L FeS2 ��Ԫ��ת��ΪCaSO4�����ڿ���� AlO2����CO2��2H2O�� Al(OH)3����HCO3�� 1��16
��������
(1)��NaOH��Һ���չ�����SO2������HSO3-������Ksp= c(Ca2+) c(![]() )����c(
)����c(![]() )��
)��
(2) �ٲ�����CaO�Ŀ����SԪ�ص���Դ��FeS2�ͽ��������Σ����������εķֽ��¶Ƚϸߣ�
��700�決��ʱ������1%CaO�Ŀ����ȥ���ʵͣ�����CaO����ת��ΪCaSO4���γɵ������ηֽ��¶Ƚϸߣ�
(3)����ǰʹ��NaOH��Һ���м����Al2O3ת��ΪNaAlO2�������ˡ��õ�����Һ����Ҫ����AlO2-�����ˡ��õ�����Һ��ͨ�����CO2�����Խ�AlO2-ת��ΪAl(OH)3��
(4) �����ˡ��õ��������к�������Fe2O3��Fe2O3��FeS2��Ϻ���ȱ�������±�������Fe3O4��SO2�����ݵ�ʧ�����غ���м��㡣
(1) ��NaOH��Һ���չ�����SO2������HSO3-����Ӧ�����ӷ���ʽΪ��SO2+OH=HSO3��Ksp= c(Ca2+) c(![]() )�ɵ�c(
)�ɵ�c(![]() )=
)=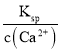 =
=![]() =2.8��10-7mol/L��
=2.8��10-7mol/L��
(2) �ٲ�����CaO�Ŀ����SԪ�ص���Դ��FeS2�ͽ��������Σ����������εķֽ��¶Ƚϸߣ����Կ����жϱ��չ�����SԪ�ص���Ҫ��Դ��FeS2��
��700�決��ʱ������1%CaO�Ŀ����ȥ���ʵͣ�����CaO����ת��ΪCaSO4���γɵ������ηֽ��¶Ƚϸߣ����Իᵼ��S��ȥ���ʽ��ͣ�
(3)����ǰʹ��NaOH��Һ���м����Al2O3ת��ΪNaAlO2�������ˡ��õ�����Һ����Ҫ����AlO2-�����ˡ��õ�����Һ��ͨ�����CO2�����Խ�AlO2-ת��ΪAl(OH)3�����ӷ���ʽΪAlO2����CO2��2H2O�� Al(OH)3����HCO3����
(4) �����ˡ��õ��������к�������Fe2O3��Fe2O3��FeS2��Ϻ���ȱ�������±�������Fe3O4��SO2������xmol Fe2O3��ymol FeS2�μӷ�Ӧ�����ݵ�ʧ�����غ�ɵ�2x��(3-![]() )=2y��5+y��(
)=2y��5+y��(![]() )�����
)�����![]() =
=![]() ������������ȫ��Ӧ���ĵ�n(FeS2)��n(Fe2O3)=1:16��
������������ȫ��Ӧ���ĵ�n(FeS2)��n(Fe2O3)=1:16��


 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������˵��2HI��g��H2��g��+I2��g���Ѵ�ƽ��״̬����__________
�ٵ�λʱ��������nmolH2��ͬʱ������nmolHI��
��1��H��H�����ѵ�ͬʱ��2��H��I�����ѣ�
�ۻ�����аٷ����ΪHI%=I2%��
�ܷ�Ӧ����v��H2��=v��I2��=![]() v��HI��ʱ��
v��HI��ʱ��
�ݻ��������c��HI����c��H2����c��I2��=2��1��1ʱ��
���¶Ⱥ����һ��ʱ��ijһ������Ũ�Ȳ��ٱ仯��
���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯��
������һ������������ƽ�������������ٱ仯��
���¶Ⱥ����һ��ʱ������������ɫ���ٱ仯��
���¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٱ仯��
�����ޡ����˵������˵��2NO2N2O4�ﵽƽ��״̬����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�����mgͭ���Ͻ���Ʒ��ͭ������������

����˵������ȷ����![]()
A.�ռ�����VL���嶼��NO
B.�����õ��IJ��������ǣ��ձ���©����������
C.������Ӧ��ϴ��
D.����������֪������������Ͻ���ͭ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���![]() ����1L
����1L![]() ��Һ�У���ֽ���
��Һ�У���ֽ���![]() ������Һ������仯
������Һ������仯![]() ����֪��
����֪��![]() ��
��![]() �������й�˵����ȷ����
�������й�˵����ȷ����
A.��ͬ�¶��£�AgCl���ܽ��Ա�![]() ��
��
B.����ת����Ӧ![]() ��ƽ�ⳣ��Ϊ
��ƽ�ⳣ��Ϊ![]()
C.��Ϻ���Һ�еģ�![]()
![]()
![]()
![]()
D.��Ϻ���Һ�еģ�![]()
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������װ�ú������ܴﵽʵ��Ŀ����![]()
A.  ��ȡ���ռ�����
��ȡ���ռ�����
B.  �ռ����ⶨ���������
�ռ����ⶨ���������
C. 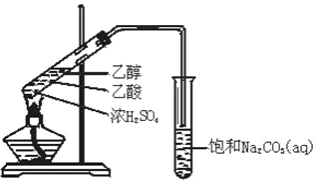 ����������
����������
D. 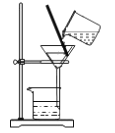 �ñ��������ˮ�еĵⵥ��
�ñ��������ˮ�еĵⵥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йؼס��ҡ��������ĸ�ͼʾ��������ȷ���ǣ� ��
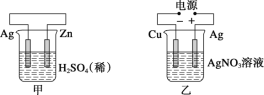
A.���и�����ӦʽΪ2H����2e��=H2��
B.����������ӦʽΪAg����e��=Ag
C.����H����̼�������ƶ�
D.���е�ʼʱ������������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
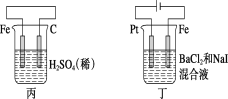
����Ŀ��(10��)����ͼ��ʾװ�ÿ�������ȡ�۲�Fe(OH)2�ڿ����б�����ʱ��ɫ�ı仯��ʵ��ʱ����ʹ����м��6 mol/L�����ᣬ�����Լ���ѡ����д���пհס�
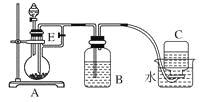
��1��B��ʢһ������NaOH��Һ��A��ӦԤ�ȼ�����Լ���____________��A�з�Ӧ�����ӷ���ʽ�ǣ�_________��
��2��ʵ�鿪ʼʱ���Ƚ�����E______(�������������ر���)��C���ռ����������Ҫ�ɷ���________��
��3����������Fe(OH)2�IJ�������________________��
��4����ȥװ��B�е���Ƥ����ʹ�������룬д���йط�Ӧ�Ļ�ѧ����ʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��G��Ϊ�������л������֮��������ת����ϵ����֪����A��һ��ֲ���������ڼ����д������ã���ȩ�����������ױ��������Ȼ����ش��������⣺ 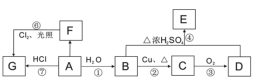
(1)A��B�й��������Ʒֱ���_______��_______��
(2)��F���ڶ�ͬϵ���У���6��̼ԭ�ӵ�ͬϵ����ͬ���칹����_______��
(3)��Ӧ���������ɵõ�G��Ҫ�Ʊ��õ��ϴ�����G��Ӧ��ѡ�÷�Ӧ_________��
(4)��Ӧ��������ȡ����Ӧ����_______����Ӧ���У�Ũ�����������___________________��������Һ��C��Ӧ�Ļ�ѧ����ʽΪ______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����( )
A.��״���£�4.48L��Cl2ͨ��ˮ�з�Ӧת�Ƶĵ�����Ϊ0.2NA
B.������pH=3��FeCl3��Һ����ˮ�������H+����ĿΪ0.001NA
C.273K��101kPa�£�22.4L������ȼ�պ������������ķ�������ΪNA
D.1L0.1molL1����������Һ�к��е�H-O������ĿΪ0.1NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com