
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,4.48L的Cl2通入水中反应转移的电子数为0.2NA
B.常温下pH=3的FeCl3溶液中由水电离出的H+的数目为0.001NA
C.273K、101kPa下,22.4L甲烷充分燃烧后,所得气体产物的分子总数为NA
D.1L0.1molL1氢氧化钠溶液中含有的H-O键的数目为0.1NA
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为___________。利用喷雾干燥法脱硫工艺也是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下吸收液中c(Ca2+)一直保持为0.50 mol·L-1,已知KSP(CaSO3)=1.4×10-7,则吸收后溶液中![]() 的浓度______________________。
的浓度______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示:
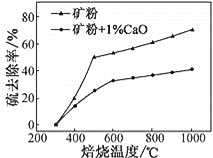
已知:多数金属硫酸盐的分解温度都高于600℃;硫去除率=(1![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于____________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是________________。
(3)向“过滤”得到的滤液中通入过量CO2,含铝粒子反应的离子方程式_________
(4) “过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干冰、石墨、C60、氟化钙和金刚石的结构模型如下(石墨仅表示其中的一层结构):

回答下列问题:
(1)干冰晶胞中,每个CO2分子周围有________个与之紧邻且等距的CO2分子。
(2)由金刚石晶胞可知,每个金刚石晶胞占有________个碳原子。
(3)石墨层状结构中,平均每个正六边形占有的碳原子数是________。
(4)在CaF2晶体中,Ca2+的配位数是________,F-的配位数是________。
(5)固态时,C60属于________ (填“共价”或“分子”)晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH 和原子半径的关系如图所示,其中Y为碳元素。下列说法正确的是
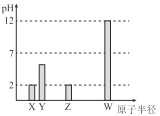
A.X是硫元素
B.Y的最高价氧化物的电子式为![]()
C.W 的最高价氧化物对应的水化物中仅含离子键
D.Z的最高价氧化物对应水化物的化学式为HZO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是( )
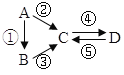
A.若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO
B.若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为 △H 2=△H 1+△H 3
C.若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)![]() 4Na+O2↑
4Na+O2↑
D.若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )

A. C、D、E的氢化物的稳定性:C>D>E
B. 元素A的原子最外层轨道中无自旋状态相同的电子
C. 元素B、C之间不可能形成化合物
D. 与元素B同周期且第一电离能最小的元素的单质能与H2O发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B.P4和CH4都是正四面体型分子且键角都为109.5°
C.NH4+的电子式为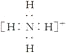 ,离子呈平面正方形结构
,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为__________________________________。如果将1molFeCl3全部制成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________NA(选填“大于”“等于”“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______
(2)D元素位于周期表中___________周期____________族
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)电子式表示化合物 C2D 的形成过程:________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com