
【题目】(10分)如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。填写下列空白。
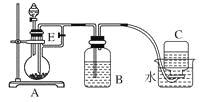
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是____________,A中反应的离子方程式是:_________。
(2)实验开始时就先将活塞E______(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________。
【答案】(1)铁屑 Fe+2H+=Fe2++H2↑ (2)打开 H2
(3)关闭活塞E,使FeSO4溶液压入B瓶中进行反应 (4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】试题(1)B中盛一定量的NaOH溶液,则A中必须提供亚铁离子,所以应预先加入的试剂是铁粉,A中反应的离子方程式是Fe+2H+=Fe2++H2↑。
(2)为防止生成的氢氧化亚铁被氧化,则需要利用反应中产生的氢气排尽装置中的空气,则实验开始时就先将活塞E打开,C中收集到气体的主要成分是氢气。
(3)要产生氢氧化亚铁,则需要把A装置中生成的硫酸亚铁压入B中,则生成Fe(OH)2的操作过程为关闭活塞E,使FeSO4溶液压入B瓶中进行反应。
(4)拔去装置B中的橡皮塞,使空气进入,此时氢氧化亚铁被氧化,有关反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
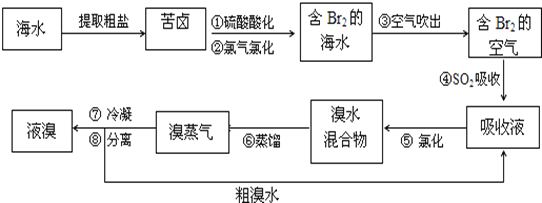
(1)步骤①中用硫酸酸化可提高Cl2的利用率,理由是__________________________。
(2)步骤②反应的离子方程式为__________________________;步骤④利用了SO2的还原性,反应的离子方程式为__________________________。
(3)步骤⑥的蒸馏过程中,温度应控制在8090℃。温度过高或过低都不利于生产,请解释原因______________________。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是__________________。
(5)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )

A.1.75mol·L-1B.3.50mol·L-1
C.0.85mol·L-1D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为___________。利用喷雾干燥法脱硫工艺也是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下吸收液中c(Ca2+)一直保持为0.50 mol·L-1,已知KSP(CaSO3)=1.4×10-7,则吸收后溶液中![]() 的浓度______________________。
的浓度______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示:
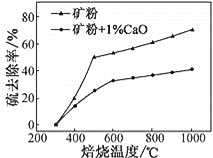
已知:多数金属硫酸盐的分解温度都高于600℃;硫去除率=(1![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于____________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是________________。
(3)向“过滤”得到的滤液中通入过量CO2,含铝粒子反应的离子方程式_________
(4) “过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种有机物Q(![]() )与P(
)与P(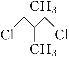 ),下列有关它们的说法中正
),下列有关它们的说法中正
确的是( )
A.二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3∶1
B.二者在NaOH醇溶液中均可发生消去反应
C.一定条件下,二者在NaOH溶液中均可发生取代反应
D.Q的一氯代物只有1种、P的一溴代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】借助太阳能将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如下图所示。下列说法不正确的是
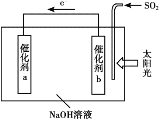
A. 该装置可将太阳能转化为化学能
B. 催化剂b附近的溶液pH增大
C. 吸收1mol SO2,理论上能产生1mol H2
D. 催化剂a表面发生的反应为:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定 O2含量,右图为某种氧电化学传感器的 原理示意图。已知在测定O2含量过程 中,电解质溶液的质量保持不变。一定时 间内,若通过传感器的待测气体为aL(标 准状况),某电极增重了b g。下列说法正确的是
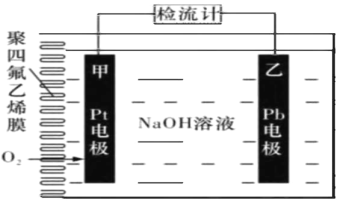
A.Pt电极为负极
B.反应过程中转移OH-的物质的量为0.125bmol
C.Pb电极上发生的电极反应为Pb-2e- +2OH- = Pb(OH)2
D.待测气体屮氧气的体积分数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干冰、石墨、C60、氟化钙和金刚石的结构模型如下(石墨仅表示其中的一层结构):

回答下列问题:
(1)干冰晶胞中,每个CO2分子周围有________个与之紧邻且等距的CO2分子。
(2)由金刚石晶胞可知,每个金刚石晶胞占有________个碳原子。
(3)石墨层状结构中,平均每个正六边形占有的碳原子数是________。
(4)在CaF2晶体中,Ca2+的配位数是________,F-的配位数是________。
(5)固态时,C60属于________ (填“共价”或“分子”)晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B.P4和CH4都是正四面体型分子且键角都为109.5°
C.NH4+的电子式为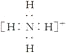 ,离子呈平面正方形结构
,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com