
【题目】某同学设计如下实验测量mg铜银合金样品中铜的质量分数:

下列说法不正确的是![]()
A.收集到的VL气体都是NO
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.根据题中已知条件不能求出合金中铜的质量分数
【答案】D
【解析】
A、由流程图可知,实验排水法收集,二氧化氮能与水反应生成NO;
B、过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒;
C、由流程图可知,溶液中加入氯化钠,将银离子转化为氯化银沉淀,通过测定氯化银沉淀的质量,计算银的质量,进而计算铜的含量,操作Ⅱ是在过滤之后,烘干之前,由于过滤后的氯化银附着一些离子,应洗涤附着的物质,防止影响氯化银的质量测定;
D、由流程图可知,实验原理为,在反应后溶液中加入氯化钠,将银离子转化为氯化银沉淀,通过测定氯化银沉淀的质量,计算银的质量,进而计算铜的含量。
A、由流程图可知,金属与硝酸反应生成的是NO或![]() 或NO与
或NO与![]() 混合气体,实验排水法收集,二氧化氮能与水反应生成NO,最后收集的气体为NO,故A不符合题意;
混合气体,实验排水法收集,二氧化氮能与水反应生成NO,最后收集的气体为NO,故A不符合题意;
B、过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒,故B不符合题意;
C、由流程图可知,溶液中加入氯化钠,将银离子转化为氯化银沉淀,通过测定氯化银沉淀的质量,计算银的质量,进而计算铜的含量,操作Ⅱ是在过滤之后,烘干之前,由于过滤后的氯化银附着一些离子,应洗涤附着的物质,防止影响氯化银的质量测定,故操作Ⅱ应是洗涤,故C不符合题意;
D、氯化银的质量为wg,所以合金中银的质量为![]() ,故合金中铜的质量分数为
,故合金中铜的质量分数为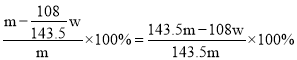 ,故D符合题意;
,故D符合题意;
故选D。


科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
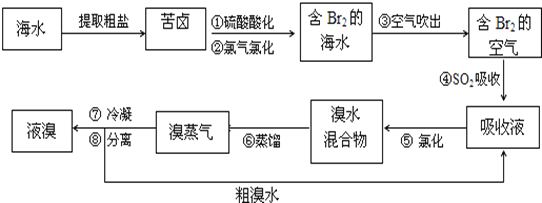
(1)步骤①中用硫酸酸化可提高Cl2的利用率,理由是__________________________。
(2)步骤②反应的离子方程式为__________________________;步骤④利用了SO2的还原性,反应的离子方程式为__________________________。
(3)步骤⑥的蒸馏过程中,温度应控制在8090℃。温度过高或过低都不利于生产,请解释原因______________________。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是__________________。
(5)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下反应:A2(g)+3 B2(g)![]() 2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
A.Q2 = 2 Q1 B.2Q1 < Q2
C.Q1 < Q2 < 92.4 kJ D.Q1 = Q2 < 92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.氯气跟水反应Cl2+H2O=2H++Cl-+ClO-
B.二氧化锰跟浓盐酸共热制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
D.向稀漂白粉溶液中通入足量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从500mL1mol·L-1的CuSO4溶液中取出100mL,下列关于100mL溶液的叙述错误的是()
A.CuSO4的物质的量浓度为1mol·L-1
B.SO42-的物质的量浓度为1mol·L-1
C.含Cu2+的物质的量为0.1mol
D.含CuSO4的质量为80.0g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )

A.1.75mol·L-1B.3.50mol·L-1
C.0.85mol·L-1D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为___________。利用喷雾干燥法脱硫工艺也是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下吸收液中c(Ca2+)一直保持为0.50 mol·L-1,已知KSP(CaSO3)=1.4×10-7,则吸收后溶液中![]() 的浓度______________________。
的浓度______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示:
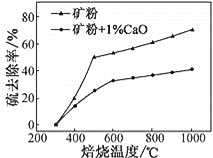
已知:多数金属硫酸盐的分解温度都高于600℃;硫去除率=(1![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于____________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是________________。
(3)向“过滤”得到的滤液中通入过量CO2,含铝粒子反应的离子方程式_________
(4) “过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干冰、石墨、C60、氟化钙和金刚石的结构模型如下(石墨仅表示其中的一层结构):

回答下列问题:
(1)干冰晶胞中,每个CO2分子周围有________个与之紧邻且等距的CO2分子。
(2)由金刚石晶胞可知,每个金刚石晶胞占有________个碳原子。
(3)石墨层状结构中,平均每个正六边形占有的碳原子数是________。
(4)在CaF2晶体中,Ca2+的配位数是________,F-的配位数是________。
(5)固态时,C60属于________ (填“共价”或“分子”)晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com