
【题目】工业上电解NO制备NH4NO3,其工作原理如图所示(图中电极均为石墨电极)。下列说法错误的是

A. a 极连接电源的负极
B. 阳极反应为NO+5e-+6H+=NH4++H2O
C. 总反应方程式为8NO+7H2O![]() 3NH4NO3+2HNO3
3NH4NO3+2HNO3
D. 为使电解产物全部转化为NH4NO3,需补充物质A,A 是NH3
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol/L.对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol(Lmin)﹣1
B.分别用B,C,D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol(Lmin)﹣1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和KCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,Y电极反应式是、发生反应.在X极附近观察到的现象是电极反应式是检验Y电极反应产物的方法是
(2)若X、Y都是银电极,a是稀硝酸银溶液,开始实验,X极的电极反应式是 . Y电极的电极反应式是 , 电解前后硝酸银溶液的浓度(变大、变小或不变)若某电极质量增重108克,则在电路中有mol的电子发生转移.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇: 反应I:CO(g)+2H2(g)CH3OH(g)△H1
反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H10 (填“>”、“=”或“<”).
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)=0.8mol/L,则CO的转化率为 , 此时的温度为(从上表中选择).
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是 .
a、容器各物质的浓度保持不变; b、容器内压强保持不变;
c、υ(CO)消耗═1/2υ(H2)生成 d、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式: .
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下).请根据图示回答下列问题: 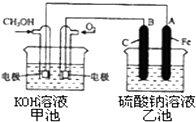
①通入甲醇蒸气的电极应为极(填写“正”或“负”),该电极上发生的电极反应是(填字母代号).
a.2CH3OH﹣12e﹣+3O2═2CO2+4H2O
b.CH3 OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
c.O2+2H2O+4e﹣═4OH﹣
d.O2﹣4e﹣+4H+═2H2O
②写出电极A的名称 . 写出B电极的电极反应式 .
③当碱性甲醇燃料电池消耗3.36L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 煤经气化和液化这两个物理过程,可变为清洁能源
B.石油分馏可获得乙酸、苯及其衍生物
C.通过石油的裂化可以得到乙烯、丙烯等重要化工基本原料
D.煤干馏可转化为焦炉气、煤焦油、焦炭等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某单质A经如下图所示的过程,请回答下列问题:
![]()
(1)若A为淡黄色固体,B是有刺激性气味的无色气体。
①A、D的化学式分别为:A__________ D__________
②工业生产中大量排放的B气体被雨水吸收后形成___________而污染环境。
③写出B→C反应的化学方程式:__________________________________________
(2)若C为淡黄色固体。
①C的电子式为___________,C中阴阳离子数目比为_________
②写出C→D反应的离子方程式:___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入富含溴离子的海水中,把溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及的反应有
①______________(写出离子方程式);
②3Br2+3CO32-===![]() +5Br+3CO2;
+5Br+3CO2;
③![]() +5Br+6H+===3Br2+3H2O。
+5Br+6H+===3Br2+3H2O。
其中反应②中氧化剂是________,还原剂是________。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式:_______________。
(3)溶剂萃取法。该法是利用单质溴在水中和有机溶剂中溶解度不同的原理来进行的。实验室中萃取用到的实验仪器名称是________。下列可以用于海水中溴的萃取的溶剂是_______(填序号)。
①乙醇 ②四氯化碳 ③硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com