
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇: 反应I:CO(g)+2H2(g)CH3OH(g)△H1
反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H10 (填“>”、“=”或“<”).
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)=0.8mol/L,则CO的转化率为 , 此时的温度为(从上表中选择).
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是 .
a、容器各物质的浓度保持不变; b、容器内压强保持不变;
c、υ(CO)消耗═1/2υ(H2)生成 d、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式: .
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下).请根据图示回答下列问题: 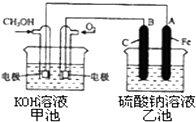
①通入甲醇蒸气的电极应为极(填写“正”或“负”),该电极上发生的电极反应是(填字母代号).
a.2CH3OH﹣12e﹣+3O2═2CO2+4H2O
b.CH3 OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
c.O2+2H2O+4e﹣═4OH﹣
d.O2﹣4e﹣+4H+═2H2O
②写出电极A的名称 . 写出B电极的电极反应式 .
③当碱性甲醇燃料电池消耗3.36L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是 .
【答案】
(1)Ⅰ;<;80%;250℃; d
(2)CH3OH(l)+ ![]() O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol
O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol
(3)负; b;阴极;4OH﹣﹣4e﹣═O2↑+2H2O;0.45mol
【解析】解:(1)①“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中,分析反应可知,反应Ⅰ中原子利用率为100%,符合“原子经济”,故答案为:Ⅰ;
②由表数据可知,温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正向放热反应,即△H1<0,故答案为:<;
③按反应Ⅰ充分反应达到平衡后,测得c(CH3OH)=0.8mol/L,其物质的量为1.6mol,则:
CO (g)+2H2 (g)CH3OH (g)
起始量(mol):2 6 0
变化量(mol):1.6 3.2 1.6
平衡量(mol):0.4 2.8 1.6
CO的转化率= ![]() ×100%=80%,
×100%=80%,
此时的平衡常数K=  ≈2.041,所以温度为250℃,
≈2.041,所以温度为250℃,
故答案为:80%;250℃;
④a.容器各物质的浓度保持不变,说明反应到达平衡,故a正确;
b.随反应进行,容器内气体物质的量进行,容器内压强减小,容器内压强保持不变,说明反应到达平衡,故b正确;
c.由方程式可知υ(CO)生成═ ![]() υ(H2)生成,而υ(CO)消耗═
υ(H2)生成,而υ(CO)消耗═ ![]() υ(H2)生成,说明υ(CO)生成═υ(CO)消耗,反应到达平衡状态,故c正确;
υ(H2)生成,说明υ(CO)生成═υ(CO)消耗,反应到达平衡状态,故c正确;
d.混合气体总质量不变,容器容积始终不变,容器内的密度始终保持不变,故d错误,
故选:d;(2)1mol甲醇燃烧放出的热量为363.26kJ× ![]() =726.52 kJ,热化学方程式为:CH3OH(l)+
=726.52 kJ,热化学方程式为:CH3OH(l)+ ![]() O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol,
O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol,
故答案为:CH3OH(l)+ ![]() O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol;(3)①原电池负极发生氧化反应,反应中甲醇发生氧化反应,甲醇蒸气的电极应为负极,甲醇失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3 OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,
O2(g )═CO2(g )+2H2O(l)△H1=﹣726.52 kJ/mol;(3)①原电池负极发生氧化反应,反应中甲醇发生氧化反应,甲醇蒸气的电极应为负极,甲醇失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3 OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,
故答案为:负;b;
②电解池中A连接电源负极,则A为阴极,B连接电源正极,B为阳极,阳极上发生氧化反应,氢氧根离子放电生成氧气与水,阳极电极反应式为:;4 OH﹣﹣4 e﹣═O2↑+2H2O,
故答案为:阴极;4 OH﹣﹣4 e﹣═O2↑+2H2O;
③标况下,3.36L 氧气物质的量为 ![]() =0.15mol,电解池总反应为2H2O
=0.15mol,电解池总反应为2H2O ![]() 2H2↑+O2↑,根据电子转移守恒,生成氢气、氧气物质的量为3×0.15mol=0.45mol,
2H2↑+O2↑,根据电子转移守恒,生成氢气、氧气物质的量为3×0.15mol=0.45mol,
故答案为:0.45mol.
(1)①“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中;
②由表数据可知,温度升高,平衡常数减小,说明平衡逆向进行;
③按反应Ⅰ充分反应达到平衡后,测得c(CH3OH)=0.8mol/L,其物质的量为1.6mol,则:
CO (g)+ | 2H2 (g) | CH3OH (g) | |
起始(mol) | 2 | 6 | 0 |
转化(mol) | 1.6 | 3.2 | 1.6 |
平衡(mol) | 0.4 | 2.8 | 1.6 |
CO转化率= ![]() ×100%;根据K=
×100%;根据K= ![]() 计算平衡常数,进而判断温度;
计算平衡常数,进而判断温度;
④可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;(2)1mol甲醇燃烧放出的热量为363.26kJ× ![]() =726.52 kJ,注明物质的聚集状态与反应热书写热化学方程式;(3)①原电池负极发生氧化反应,反应中甲醇发生氧化反应,失去电子,碱性条件下生成碳酸根离子与水;
=726.52 kJ,注明物质的聚集状态与反应热书写热化学方程式;(3)①原电池负极发生氧化反应,反应中甲醇发生氧化反应,失去电子,碱性条件下生成碳酸根离子与水;
②电解池中A连接电源负极,则A为阴极,B连接电源正极,B为阳极,阳极上发生氧化反应,氢氧根离子放电生成氧气与水;
③电解池总反应为2H2O ![]() 2H2↑+O2↑,根据电子转移守恒计算氢气、氧气物质的量.
2H2↑+O2↑,根据电子转移守恒计算氢气、氧气物质的量.


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.可以利用铝热反应冶炼高熔点的金属
B.现代石油化工,采作银作催化剂可以实现一步完成乙烯转化为环氧乙烷的过程,该反应的原子利用率为100%
C.工业上制溴是向酸化的浓缩海水中直接通入氯气置换出溴即可
D.煤直接液化可得液体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取,回答下列问题。
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
①C2H6(g)=C2H4(g) +H2(g) ΔH1=+136 kJ/mol
②C2H6(g)+ ![]() O2(g)= C2H4(g)+H2O(g) ΔH2=-110 kJ/mol
O2(g)= C2H4(g)+H2O(g) ΔH2=-110 kJ/mol
已知反应相关的部分化学键键能数据如下:
化学键 | H-H(g) | H-O(g) | O=O(g) |
键能( kJ/mol) | 436 | X | 496 |
由此计算x=_________,通过比较△H1和△H2,说明和热裂解法相比,氧化裂解法的优点是_______________________________(任写一点)。
(2)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是______,反应的最佳温度为____________(填选项序号)。
A.700℃ B.750℃ C.850℃ D.900℃
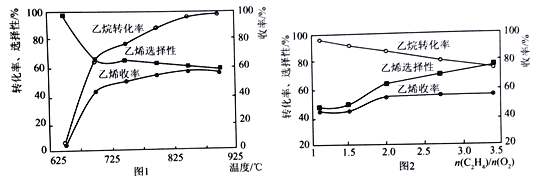
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(3)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中n(C2H6)/n(O2)的最佳值是_______________,判断的理由是__________________________________。
(4)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___________________________。
反应达平衡时,各组分的体积分数如下表:
C2H6 | O2 | C2H4 | H2O | 其他物质 |
2.4% | 1.0% | 12% | 15% | 69.6% |
计算该温度下的平衡常数Kp=_________(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素是构成细胞的最基本元素,对此最有说服力的解释是
A. 碳在细胞的各种化合物中含量最多 B. 碳在自然界中含量最为丰富
C. 在细胞的各种化合物中都含有碳 D. 碳链构成了有机物的基本骨架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.任何情况下,温度都不可能对反应的方向起决定性作用
C.焓变与熵变是判断反应方向的两个主要因素
D.自发反应在任何条件下都能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解NO制备NH4NO3,其工作原理如图所示(图中电极均为石墨电极)。下列说法错误的是

A. a 极连接电源的负极
B. 阳极反应为NO+5e-+6H+=NH4++H2O
C. 总反应方程式为8NO+7H2O![]() 3NH4NO3+2HNO3
3NH4NO3+2HNO3
D. 为使电解产物全部转化为NH4NO3,需补充物质A,A 是NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡中的咖啡酸具有抗氧化、抗炎、抗粥样硬化等多种有益作用。其球棍模型如图所示,关于咖啡酸的下列说法正确的是
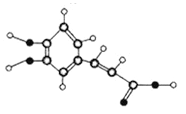
A. 分子式为C9H10O4
B. 分子中至少有9个碳原子共平面
C. 1 mol咖啡酸与足量NaHCO3反应生1 mol CO2
D. 1 mol咖啡酸最多能够与5 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。
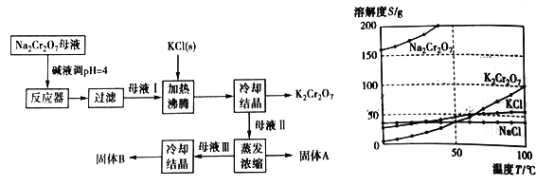
(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。固体B的主要成分为___________________(填化学式)。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。进一步提纯产品的方法是___________________。
(5)+6价Cr的毒性很高,工业上用电解法来处理含Cr2O72-的废水。下图为电解装置示意图,电极材料分别为铁和石墨。通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a 极附近变成Cr(OH)3沉淀而被除去。
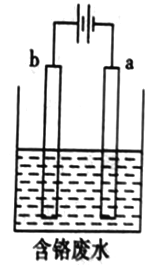
①在以上处理过程中,Cr2O72-转化为毒性较低的Cr3+的离子方程式为________________________。
②a电极的电极反应式是是____________________;电解一段时间后在阴极区有Fe(OH)3和Gr(OH)3沉淀生成,若电解后的溶液中c(Cr3+)为3×10-5mol·L-1,则溶液中c(Fe3+)为____________ mol·L-1。已知:Ksp=[Fe(OH)3]=4.0×10-38,K[Cr(OH)3]=6.0×10-31。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾与水反应的实验如下图所示:

(1)钠、钾与水反应两个实验现象的相同点:
①金属________水面上;
②金属________成闪亮的小球;
③小球四处游动;
④产生嘶嘶的声音;
⑤反应后的溶液使酚酞________。
(2)_______与水反应有轻微的爆鸣声,并很快燃烧起来。
(3)实验结论:________更易与水反应,且反应更_____________________________________。
(4)钾与水反应的化学方程式是___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com