
【题目】为了探究HCl、H2CO3和H2SiO3的酸性强弱,某学生设计了如图所示的实验装置,一次实验即可达到实验目的(不必选用其他酸性物质)请回答下列问题:
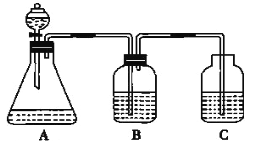
(1)锥形瓶中装有某种可溶性正盐溶液,则分液漏斗中所盛试剂应为_______。
(2)装置B中所盛的试剂是_______,其作用是_______。
(3)装置C中所盛的试剂是_______,C中所发生反应的离子方程式为_______。
(4)由此得出HCl、H2CO3、H2SiO3的酸性强弱顺序是____________。
【答案】盐酸碳酸氢钠溶液除去CO2中混有的HCl硅酸钠溶液CO2+H2O+SiO32-=CO32-+H2SiO3↓HCl>H2CO3>H2SiO3
【解析】
(1)根据较强酸制取较弱酸的原则,分液漏斗中应盛放三种酸中最强的酸,最强的酸是盐酸,所以分液漏斗中所盛试剂名称是盐酸;
(2)盐酸有挥发性,导致生成的二氧化碳气体中含有HCl气体,会对实验造成干扰,所以B装置要盛放能除去HCl气体,且不引入新的杂质、不能和二氧化碳反应的药品,一般常用饱和碳酸氢钠溶液,该试剂的作用是除去二氧化碳中的HCl气体杂质;
(3)硅酸钠能和二氧化碳、水反应生成硅酸和碳酸钠,反应的离子方程式为CO2+H2O+SiO32-=CO32-+H2SiO3↓;
(4)根据以上分析可知盐酸、碳酸、硅酸的酸性强弱顺序是HCl>H2CO3>H2SiO3。


科目:高中化学 来源: 题型:
【题目】如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是

A. 盐酸中逐滴加入食盐溶液
B. NH4Cl溶液中加入适量的NaOH溶液
C. Ba(OH)2溶液中滴入H2SO4溶液至过量
D. 醋酸中逐滴加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲表示某吸热反应在无催化剂(a)和有催化剂(b)时反应的能量变化
B. 图乙表示常温下,0.1mol/LNaOH溶液滴定20.00mL0.1mol/L醋酸溶液的滴定曲线
C. 图丙表示某可逆反应的反应速率随时间的变化关系,t0时刻改变的条件是使用了催化剂
D. 图丁表示一定质量冰醋酸加水稀释过程中、溶液导电能力变化曲线,且醋酸电离程度:a<b<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO![]() 、SO
、SO![]() 、Cl﹣中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如下图所示:(提示:Al3+与CO
、Cl﹣中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol/L的硝酸,实验过程中沉淀质量的变化情况如下图所示:(提示:Al3+与CO![]() 不共存)
不共存)

(1)水样中一定含有的阴离子是_____,其物质的量浓度之比为_____.
(2)写出BC段所表示反应的离子方程式:_____.
(3)由B到C点变化过程中消耗硝酸的体积为_____.
(4)试根据实验结果推测K+是否存在?_____(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是_____.(若K+不存在,则不必回答该问).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制晶的主要原料。已知多晶硅第三代工业制取流程如图所示:
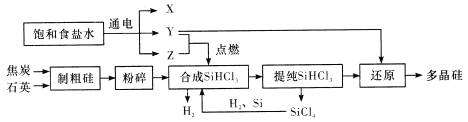
下列说法错误的是
A. Y、Z分别为H2、Cl2
B. 制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1:1
C. SiHCl3极易水解,其完全水解的产物为H2SiO3、H2、HCl,据此推测SiHCl3中硅元素的化合价为+2价
D. Y与SiHCl3制备多晶硅的反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述错误的是
编号 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热用砂纸打磨过的铝箔 | 铝箔变软,失去光泽,熔化的铝并不滴落 |
C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
D | 将水蒸气通过灼热的铁粉 | 黑色粉末变为红褐色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
(1)该反应的平衡常数表达式K=__________。该反应的正反应是______反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,恒容、升高温度,原化学平衡向______反应方向移动(填“正”或“逆”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)能判断该反应是否达到化学平衡状态的依据是(_____)
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有__________(选填A、B、C、D)
n(CO) | n(H2O) | n(H2) | n(CO2) | |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 3 | 3 | 0 | 0 |
D | 0. | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有如右图所示转化关系(反应条件略)。
已知;①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:

(1)Z是(写化学式):______________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有__________性。利用这种性质可以进行__________项(填字母)实验操作。
A.钝化铁片 B.检验Ba2+ C.干燥氨气 D.干燥氯气
(3)在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是________________。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2,写出该反应的离子方程式:______________。该反应很好地解决了环保问题,但给工业生产带来了_______________的问题。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com