
【题目】已知有如右图所示转化关系(反应条件略)。
已知;①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:

(1)Z是(写化学式):______________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有__________性。利用这种性质可以进行__________项(填字母)实验操作。
A.钝化铁片 B.检验Ba2+ C.干燥氨气 D.干燥氯气
(3)在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是________________。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2,写出该反应的离子方程式:______________。该反应很好地解决了环保问题,但给工业生产带来了_______________的问题。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式:______________。
【答案】 (1)H2O (2)吸水 D (3)2∶1
(4)SO2+Br2+2H2O=2HBr+H2SO4 强酸对设备腐蚀
(5) C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
【解析】
试题X、Y、Z、W均为氧化物,常态下,X是红棕色气体,则X为NO2;Y能使澄清石灰水变浑浊但不能使品红溶液褪色,则Y为CO2;甲与M反应得到二氧化氮、二氧化碳,可推知甲为HNO3、M为碳,乙与碳反应得到二氧化碳、二氧化硫,可推知乙为H2SO4,故Z为H2O;
(1)由上述分析可知,Z为H2O。
(2)浓硫酸具有吸水性,露置在空气中一段时间,其质量增加浓度降低,可以用于干燥氯气。
(3)X和Z的反应为3NO2+H2O=2HNO3+NO,被氧化的二氧化氮生成HNO3,被还有的二氧化氮生成NO,由方程式可知,被氧化的NO2与被还原的NO2的物质的量之比是2:1。
(4)溴具有强氧化性,在溶液中奖二氧化硫氧化为硫酸,自身被还原为HBr,反应方程式为:SO2+Br2+2H2O=H2SO4+2HBr,由于生成强酸,在工业生产带来了强酸对设备腐蚀问题。
(5)碳与浓硫酸在加热条件下生成二氧化碳、二氧化氮与水,反应方程式为:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料。某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。回答下列有关问题。
(背景素材)Ⅰ.NO+CaO2=Ca(NO2)2;2NO2+CaO2=Ca(NO3)2;
II.亚硝酸具有一定的氧化性和还原性,酸性条件下:Ca(NO2)2能将I-氧化为I2;
Ⅲ.I2+2S2O32—=2I-+S4O62—
(制备Ca(NO2)2)该小组设计的制备装置如图所示(夹持装置略去)。
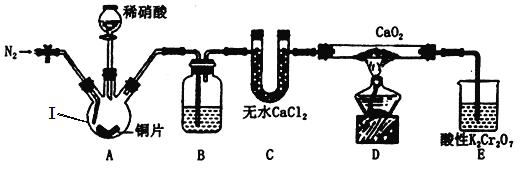
(1)仪器Ⅰ的名称是___________________;B中盛装的试剂是____________________。
(2)制备过程有关操作如下,正确顺序为_______、c、_______、_______、_______、_______。
a.向装置中通入N2 b.向仪器Ⅰ中滴加稀硝酸 c.点燃酒精灯 d.熄灭酒精灯 e.停止通入N2 f.关闭分液漏斗旋塞
(3)装置E中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3—,溶液由橙色变为绿色(Cr3+),发生反应的离子方程式为__________________________。
(4)整个过程持续通N2的作用是______________、_____________、____________。
(测定Ca(NO2)2的纯度)该小组测定产品中Ca(NO2)2纯度的方法如下:a.称取mg产品、溶解、定容至250mL;b.移取25.00mL溶液于锥形瓶中,加入过量的V1 mLc1mol/L的KI溶液并酸化;c.以淀粉为指示剂,用c2mol/L的Na2S2O3溶液滴定。进行三次平行实验,消耗标准液体积平均值为V2 mL。
(5)测定过程所需仪器在使用前必须检查是否漏液的有______________________。
(6)该产品中Ca(NO2)2的质量分数为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究HCl、H2CO3和H2SiO3的酸性强弱,某学生设计了如图所示的实验装置,一次实验即可达到实验目的(不必选用其他酸性物质)请回答下列问题:
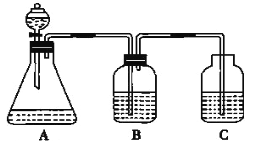
(1)锥形瓶中装有某种可溶性正盐溶液,则分液漏斗中所盛试剂应为_______。
(2)装置B中所盛的试剂是_______,其作用是_______。
(3)装置C中所盛的试剂是_______,C中所发生反应的离子方程式为_______。
(4)由此得出HCl、H2CO3、H2SiO3的酸性强弱顺序是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为

A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)计算机芯片和太阳能电池的主要成分是________,光导纤维的主要成分是___________。
(2)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为__________。
(3)工业上可利用水玻璃和盐酸反应制备硅酸凝胶后,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式_______。
(4)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,将其表示为氧化物形式为___。
(5)高纯度单晶硅可以按下列方法制备:
SiO2 ![]() Si(粗)
Si(粗) ![]() SiHCl3
SiHCl3 ![]() Si(纯)
Si(纯)
写出步骤①的化学方程式_______________________________________。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃),提纯SiHCl3主要操作的名称是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国要求在全国范围内形成全民节能减排氛围。下列有关做法中不符合这一要求的是( )
A、将煤液化、气化,提高燃料的燃烧效率
B、在汽车上安装汽车尾气催化转化装置,使之发生反应:
2CO+2NO![]() 2CO2+N2
2CO2+N2
C、在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢氧燃料电池汽车
D、在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
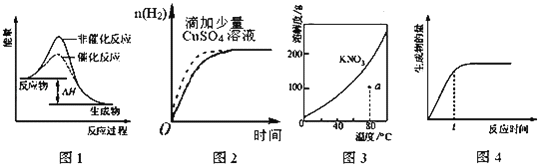
A. 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C. 图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
D. 图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式____。
(2)实验室常用MnO2与浓盐酸反应制备Cl2,装置如图所示:
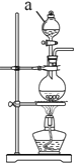
仪器a的名称为____。制备实验开始时,先检査装置气密性,接下来的操作依次是____(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图所示装置:
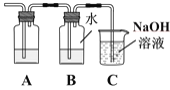
①装置A中应加入的试剂是____。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是____,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是____。
A.AgNO3溶液 B.石蕊试液 C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是____。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法____。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B. FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O
C. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D. 电解MgCl2水溶液的离子方程式:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com