
【题目】下列图示与对应的叙述相符的是( )
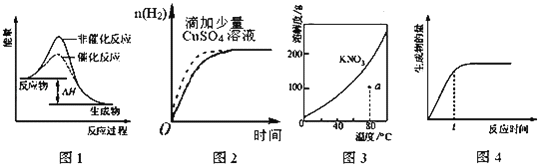
A. 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C. 图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
D. 图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲表示某吸热反应在无催化剂(a)和有催化剂(b)时反应的能量变化
B. 图乙表示常温下,0.1mol/LNaOH溶液滴定20.00mL0.1mol/L醋酸溶液的滴定曲线
C. 图丙表示某可逆反应的反应速率随时间的变化关系,t0时刻改变的条件是使用了催化剂
D. 图丁表示一定质量冰醋酸加水稀释过程中、溶液导电能力变化曲线,且醋酸电离程度:a<b<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
(1)该反应的平衡常数表达式K=__________。该反应的正反应是______反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,恒容、升高温度,原化学平衡向______反应方向移动(填“正”或“逆”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)能判断该反应是否达到化学平衡状态的依据是(_____)
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有__________(选填A、B、C、D)
n(CO) | n(H2O) | n(H2) | n(CO2) | |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 3 | 3 | 0 | 0 |
D | 0. | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有如右图所示转化关系(反应条件略)。
已知;①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:

(1)Z是(写化学式):______________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有__________性。利用这种性质可以进行__________项(填字母)实验操作。
A.钝化铁片 B.检验Ba2+ C.干燥氨气 D.干燥氯气
(3)在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是________________。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2,写出该反应的离子方程式:______________。该反应很好地解决了环保问题,但给工业生产带来了_______________的问题。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
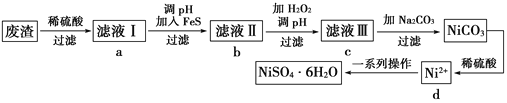
(1)向滤液Ⅰ中加入FeS是为了生成难溶于酸的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为___________________________________。
(2)对滤液Ⅱ的操作,请回答:
①往滤液Ⅱ中加入H2O2的离子方程式为________________________________。
②调滤液ⅡpH的目的是除去Fe3+,其原理是Fe3++3H2O![]() Fe(OH)3+3H+,已知25 ℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K=________________。
Fe(OH)3+3H+,已知25 ℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K=________________。
③检验Fe3+是否除尽的操作和现象是__________________________________________。
(3)滤液Ⅲ中溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___________________。
(4)得到的NiSO4溶液经蒸发浓缩、冷却结晶、过滤等一系列操作可得到NiSO4·6H2O,请回答:
①在进行蒸发浓缩操作时,加热到___________________________(描述实验现象)时,则停止加热。
②为了提高产率,过滤后得到的母液要循环使用,则应该回流到流程中的________位置(选填a、b、c、d)。
③如果得到产品的纯度不够,则应该进行________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性。下列叙述中不正确的是:
A. 红热的铜丝在氯气中剧烈燃烧,生成棕黄色烟
B. 钠在氯气中燃烧,生成白色的烟
C. 纯净的氢气在氯气中安静的燃烧,在集气瓶口形成白色烟雾
D. 氯气能与水反应生成盐酸和次氯酸,次氯酸见光易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铜粉投入FeCl3溶液中,两者恰好完全反应,完成下列问题.
(1)写出该反应的离子方程式_______________________________
(2)该反应中的氧化剂是_______,氧化产物和还原产物的物质的量之比为________
(3)若反应过程中转移了0.2mol电子,则溶解消耗的铜的质量为 ________
(4)如何检验反应后的溶液中是否含有Fe3+________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色、澄清溶液中可能含有①Na+、②SO![]() 、③Cl-、④HCO3-、⑤CO
、③Cl-、④HCO3-、⑤CO![]() 、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 | 操作 | 现象 |
(1) | 用紫色石蕊试液检验 | 溶液变红 |
(2) | 向溶液中滴加BaCl2和稀HCl | 有白色沉淀生成 |
(3) | 将(2)中所得混合物过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀生成 |
下列结论正确的是
A.肯定含有的离子是②③⑥
B.该实验无法确定是否含有③
C.可能含有的离子是①③⑦
D.肯定没有的离子是④⑤,可能含有的离子是②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com