
【题目】煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
(1)该反应的平衡常数表达式K=__________。该反应的正反应是______反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,恒容、升高温度,原化学平衡向______反应方向移动(填“正”或“逆”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)能判断该反应是否达到化学平衡状态的依据是(_____)
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有__________(选填A、B、C、D)
n(CO) | n(H2O) | n(H2) | n(CO2) | |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 3 | 3 | 0 | 0 |
D | 0. | 2 | 1 | 1 |
【答案】 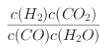 放热 逆 增大 bc BC
放热 逆 增大 bc BC
【解析】(1)![]()
![]() ,反应的平衡常数
,反应的平衡常数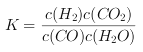 ;根据表中数据可以知道,温度升高平衡常数减小,说明平衡向逆反应方向移动,正反应为放热反应,正确答案:
;根据表中数据可以知道,温度升高平衡常数减小,说明平衡向逆反应方向移动,正反应为放热反应,正确答案: 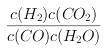 ;放热。
;放热。
(2) 反应是放热反应,温度升高,反应速率增大,平衡向逆反应方向移动,反应前后气体体积不变,等容容器中压强之比等于温度之比,所以压强增大,正确答案:逆;增大;增大。
(3) 反应前后气体体积不变,压强始终不会变化,所以压强不变,无法判断是否达到平衡状态,a错误 ;浓度不变,反应达到了化学平衡状态,b正确;正、逆反应速率相等,各组分浓度不变,达到了化学平衡状态,c正确;浓度相等时,不能判断各组分浓度是否不变,无法判断是否达到平衡状态,故d错误;正确选项bc。
(4)根据![]() 时,平衡常数
时,平衡常数![]() 计算:
计算:
根据浓度商![]() ,反应向逆反应方向移动,A错误;根据浓度商
,反应向逆反应方向移动,A错误;根据浓度商![]() ,反应向正反应方向移动,B正确;只有反应物,反应向正反应方向移动,C正确; 根据浓度商
,反应向正反应方向移动,B正确;只有反应物,反应向正反应方向移动,C正确; 根据浓度商![]() .达到平衡状态,平衡不移动,D错误;正确答案:BC。
.达到平衡状态,平衡不移动,D错误;正确答案:BC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,28g由C2H4和C3H6组成的混合气体所含原子数为6NA
B. 由0.1mol双氧水参加反应生成氧气,转移的电子总数一定为0.2NA
C. 0.lmol/L(NH4)2SO4溶液与0.2mol/LNH4Cl溶液中的NH4+数目相同
D. 2.4gT218O所含中子数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校购买的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为1.84mol/L
B. 1mol Zn与足量的该硫酸反应产生2gH2
C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究HCl、H2CO3和H2SiO3的酸性强弱,某学生设计了如图所示的实验装置,一次实验即可达到实验目的(不必选用其他酸性物质)请回答下列问题:
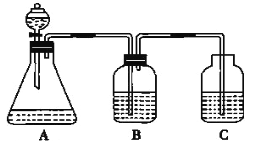
(1)锥形瓶中装有某种可溶性正盐溶液,则分液漏斗中所盛试剂应为_______。
(2)装置B中所盛的试剂是_______,其作用是_______。
(3)装置C中所盛的试剂是_______,C中所发生反应的离子方程式为_______。
(4)由此得出HCl、H2CO3、H2SiO3的酸性强弱顺序是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为

A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)计算机芯片和太阳能电池的主要成分是________,光导纤维的主要成分是___________。
(2)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为__________。
(3)工业上可利用水玻璃和盐酸反应制备硅酸凝胶后,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式_______。
(4)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,将其表示为氧化物形式为___。
(5)高纯度单晶硅可以按下列方法制备:
SiO2 ![]() Si(粗)
Si(粗) ![]() SiHCl3
SiHCl3 ![]() Si(纯)
Si(纯)
写出步骤①的化学方程式_______________________________________。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃),提纯SiHCl3主要操作的名称是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
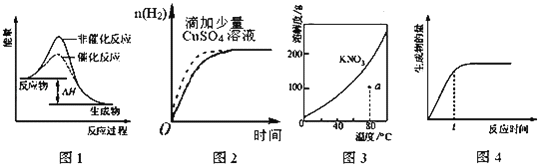
A. 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C. 图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
D. 图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
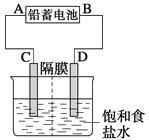
已知:铅蓄电池在放电时发生下列电极反应:
负极Pb+SO![]() -2e-===PbSO4
-2e-===PbSO4
正极PbO2+4H++SO![]() +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式_______________________________________。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量)时,
①若收集到11.2 L(标准状况下)氯气,溶液pH=_________________。
②若铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为___________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com