
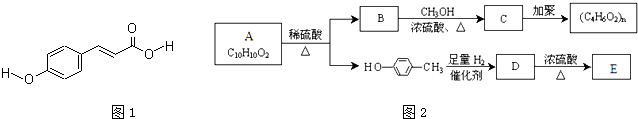
 ,A含有酯基,则A为
,A含有酯基,则A为 ,
, 与足量的氢气反应生成D,故D为
与足量的氢气反应生成D,故D为 ,D在浓硫酸、加热条件下生成E,E能使Br2/CCl4溶液褪色,故发生消去反应,E为
,D在浓硫酸、加热条件下生成E,E能使Br2/CCl4溶液褪色,故发生消去反应,E为 ,据此解答.
,据此解答. ,A含有酯基,则A为
,A含有酯基,则A为 ,
, 与足量的氢气反应生成D,故D为
与足量的氢气反应生成D,故D为 ,D在浓硫酸、加热条件下生成E,E能使Br2/CCl4溶液褪色,故发生消去反应,E为
,D在浓硫酸、加热条件下生成E,E能使Br2/CCl4溶液褪色,故发生消去反应,E为 ,
, ,C为CH2=CH-COOCH3,
,C为CH2=CH-COOCH3, ;CH2=CH-COOCH3;
;CH2=CH-COOCH3;
| 浓硫酸 |
| △ |
 +H2O,
+H2O,
| 浓硫酸 |
| △ |
 +H2O.
+H2O.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| C、稀硝酸滴在碳酸钙上:CO32-+2H+═CO2↑+H2O |
| D、二氧化碳通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
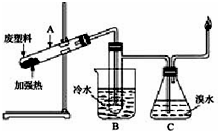 某些废旧塑料隔绝空气加强热,使其变废为宝.其实验装置如图.对某废塑料加强热得到的产物如下表:
某些废旧塑料隔绝空气加强热,使其变废为宝.其实验装置如图.对某废塑料加强热得到的产物如下表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳(固体) |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
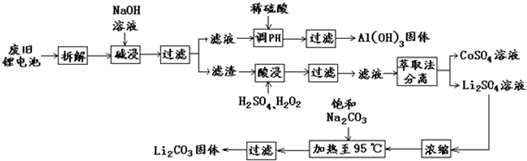
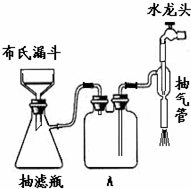
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
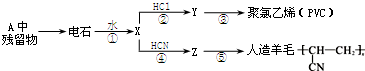
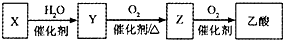 某石油化工产品X的转化关系如图,下列判断正确的是( )
某石油化工产品X的转化关系如图,下列判断正确的是( )| A、X与H2O生成Y的反应是加成反应 |
| B、1 mol Y与足量金属钠反应,能生成3 mol H2 |
| C、Z与CH3OCH3互为同分异构体 |
| D、0.1 mol?L-1乙酸溶液pH为1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com