
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、W组成的一种化合物甲,25 ℃时,0.05 mol·L-1甲溶液中,![]() =1.0×l0l2;Z原子的最外层电子数是最内层电子数的
=1.0×l0l2;Z原子的最外层电子数是最内层电子数的![]() 。下列说法正确的是
。下列说法正确的是
A. 简单离子半径:Y<Z<W
B. Z分别与X、Y形成的化合物中,化学键类型均相同
C. X分别与Y、W形成的最简单化合物的稳定性:W<Y
D. 由以上四种元素形成的化合物一定能促进水的电离
【答案】C
【解析】0.05 mol·L-1甲溶液中![]() =1.0×l0l2可知此溶液为强酸溶液且为一元酸, 可知X为H、Y为O,Z原子的最外层电子数是最内层电子数的
=1.0×l0l2可知此溶液为强酸溶液且为一元酸, 可知X为H、Y为O,Z原子的最外层电子数是最内层电子数的![]() ,可知Z为Na,同时可知W为Cl;A.简单离子结构相同时核电荷数大,离子半径小,则Na+<O2-,故A错误;B.Na分别与H形成的NaH中只存在离子键,而Na与O形成的Na2O2中除离子键,还有非极性共价键,故B错误;C.非金属性越强,氢化物越稳定,氧的非金属性比氯强,则H分别与O、Cl形成的最简单化合物的稳定性HCl<H2O,故C正确;D.由以上四种元素形成的化合物NaClO因水解能促进水的电离,但NaClO4不水解,故D错误;答案为C。
,可知Z为Na,同时可知W为Cl;A.简单离子结构相同时核电荷数大,离子半径小,则Na+<O2-,故A错误;B.Na分别与H形成的NaH中只存在离子键,而Na与O形成的Na2O2中除离子键,还有非极性共价键,故B错误;C.非金属性越强,氢化物越稳定,氧的非金属性比氯强,则H分别与O、Cl形成的最简单化合物的稳定性HCl<H2O,故C正确;D.由以上四种元素形成的化合物NaClO因水解能促进水的电离,但NaClO4不水解,故D错误;答案为C。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程: 。
(3)写出A、B两元素最高价氧化物的水化物反应的离子方程式: 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、R的化合价与原子序数的关系如下图所示.下列说法不正确的是( )
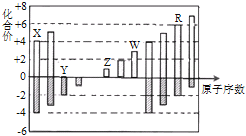
A. X、Y都存在同素异形现象
B. 工业上常用W的氧化物为原料制取单质W
C. Z和Y形成的化合物中只存在离子键
D. 常温下单质W不能溶于R的最高价氧化物对应水化物的浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷
B. 石油裂解气不能使溴的四氯化碳溶液、酸性KMnO4溶液褪色
C. 水煤气可用来合成液态烃及甲醇等含氧有机物
D. 苯与氯气在光照的条件下通过取代反制得氯苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- AlO2-
C.K+ Na+ Cl- NO3- D.K+ NH4+ SO42- NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【天津市红桥区下学期开学考试】向1L的密闭容器中加入1molX、3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
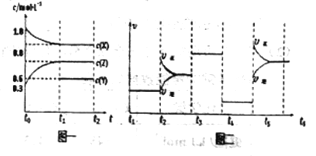
A. Y的起始物质的量为0.5mol
B. 该反应的化学方程式为:2X(g)+Y(g)![]() 3Z(g)ΔH<0
3Z(g)ΔH<0
C. 若t0=0,t1=10s,则t0-t1阶段的平均反应速率为v(z)=0.03mol/(L﹒s)
D. 反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是
A. 硝酸钠、氢氧化钠
B. 氧化铜、二氧化锰
C. 氯化钾、二氧化锰
D. 硫酸铜、氢氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。
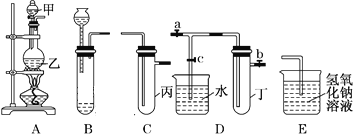
(1)实验室用装置A来制取Cl2,反应的离子方程式是______________;若将装置B、C、E相连后,用浓盐酸和______(填下列试剂的标号)为原料可制取Cl2。
a.KMnO4固体 b.KClO3固体 c.KCl固体 d.浓硫酸
(2)用装置B来制取制取氯气,并将装置B、C、E相连,在丙中加入适量水,即可制得氯水。向该氯水中加入大理石,充分振荡,观察到氯水的黄绿色逐渐褪去,同时产生少量气泡。某同学根据此现象推断出氯水呈酸性,请问该同学的推断是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,此空无需填写):_________________。
(3)为了探究氯水与大理石的反应,用装置A来制取氯气,并依次连接装置A、C、C、E。在第一个装置C的丙中,应加入的试剂是____________;在第二个装置C的丙中,加入适量水,即制得氯水。向制得的氯水中加入过量的大理石,反应结束后将所得溶液分成四等分,进行I、Ⅱ、Ⅲ、Ⅳ四个实验,实验操作如下,将实验现象或者实验结论填入下表:
实验序号 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 将该溶液滴在有色布条上 | 有色布条迅速褪色 | ①该溶液中含有__________ |
Ⅱ | 向该溶液中滴加碳酸钠溶液 | ②___________ | 该溶液中含有Ca2+ |
Ⅲ | 向该溶液中滴加稀盐酸 | 有无色气泡产生 | ③无色气体是____________ |
Ⅳ | 加热该溶液 | 溶液变浑浊并产生大量气体 | ④该溶液中含有__________ |
⑤通过上述实验,得出氯水和过量的大理石反应的化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com