
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程: 。
(3)写出A、B两元素最高价氧化物的水化物反应的离子方程式: 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示) 。
【答案】(1)A:Na, B:Al, C:Si, D:P, E:Cl
(2)![]()
(3)Al(OH)3+ OH-=AlO2-+2H2O
(4)H3PO4>H2SiO3
【解析】试题分析:A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则这三种元素分别是Na、Al、Cl。C元素的最外层电子数比次外层电子数少4,则C为2、8、4,是14号元素Si。D元素原子次外层电子数比最外层电子数多3,则D的核外电子排布是2、8、5,是15号元素P。(1)这五种元素的元素符合分别是A:Na, B:Al, C:Si, D:P, E:Cl。(2)Na与Cl两元素可形成化合物NaCl,该化合物为离子化合物。其电子式表示过程为:![]() 。(3)NaOH、Al(OH)3发生反应的方程式为:Al(OH)3+NaOH=NaAlO2+2H2O ;离子方程式为Al(OH)3+ OH-= AlO2-+ 2H2O 。(4)元素的非金属性P>Si,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。所以酸性:H3PO4>H2SiO3。
。(3)NaOH、Al(OH)3发生反应的方程式为:Al(OH)3+NaOH=NaAlO2+2H2O ;离子方程式为Al(OH)3+ OH-= AlO2-+ 2H2O 。(4)元素的非金属性P>Si,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。所以酸性:H3PO4>H2SiO3。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者小于后者的是
①C(s)+![]() O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
②S(g)+O2(g)═SO2(g)△H3;S(s)+O2(g)═SO2(g)△H4
③CaO(s)+H2O(l)═Ca(OH)2(s)△H5;CaCO3(s)═CaO(s)+CO2(g)△H6
A.② B.①② C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 焰色反应是化学变化
B. 基态碳原子的电子排布式是1s22s12p3
C. 焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱
D. 同一原子处于激发态时的能量一定大于其处于基态时的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)某温度时,Kw=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈 性。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 ;
将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据上表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度 。
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因 (写离子方程式并用必要的文字说明)。
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
资料:氰化钠化学式NaCN(N元素-3价),白色结晶颗粒,剧毒,易溶于水
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式________________。
(2)某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过下图装置制备Na2S2O3。
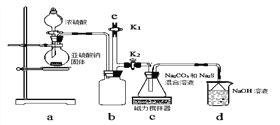
①a装置中盛浓硫酸的仪器名称是_______________;
b装置的作用是________________。
②c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有___________________。
③实验结束后,在e处最好连接盛_________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,目的是__________________
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
① 废水中氰化钠的最高排放标准为0.50 mg/L。
② Ag++2CN- = [ Ag (CN)2]-, Ag++I- = AgI↓, AgI呈黄色,且CN-优先与Ag+反应。
实验如下:
取25.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50 mL。
④滴定终点的判断方法是____________________
⑤处理后的废水中氰化钠的含量为__________mg/L,_______(选填“能”、“不能”)排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加 5.1g.下列叙述不正确的是( )
A. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
B. 参加反应的金属的总质量 3.6g<m<9.6 g
C. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100mL
D. 当金属全部溶解时收集到NO气体的体积在标况下为 2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有镁铝混合粉末10.2 g,将它溶于500 mL 4 mol·L-1的盐酸中,若要使沉淀的质量最大,则需加入2 mol·L-1的氢氧化钠溶液的体积是( )
A. 1000 mL B. 500 mL C. 100 mL D. 1500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、W组成的一种化合物甲,25 ℃时,0.05 mol·L-1甲溶液中,![]() =1.0×l0l2;Z原子的最外层电子数是最内层电子数的
=1.0×l0l2;Z原子的最外层电子数是最内层电子数的![]() 。下列说法正确的是
。下列说法正确的是
A. 简单离子半径:Y<Z<W
B. Z分别与X、Y形成的化合物中,化学键类型均相同
C. X分别与Y、W形成的最简单化合物的稳定性:W<Y
D. 由以上四种元素形成的化合物一定能促进水的电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com