
【题目】要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列哪组物质进行实验
A. Cu、FeCl2溶液、MgCl2溶液
B. Fe、Cu、MgCl2溶液
C. Mg、CuO、FeSO4溶液
D. Fe、CuSO4溶液、MgCl2溶液
科目:高中化学 来源: 题型:
【题目】下列分离混合物的方法中不正确的是( )
A.从酒精和水的混合物中分离出酒精--蒸馏法
B.使浑浊的食盐水变澄清--过滤法
C.从溴水中分离出溴--蒸馏法
D.海水制NaCl--蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图: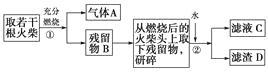
请回答以下问题:
(1)为验证气体A,按如图所示装置进行实验:若能观察到的现象,即可证明火柴头上含有S元素。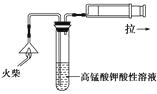
(2)步骤②的实验操作装置如图所示,该操作的名称是 , 其工作原理是。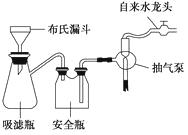
(3)要证明火柴头中含有Cl元素的后续实验步骤是?
(4)有学生提出检验火柴头上KClO3的另一套实验方案:
有关的离子方程式为 ,
有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是。
(5)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验。
实验次数 | H2O2溶液质量分数/% | H2O2溶液用量/mL | 物质D用量/g | 反应温度/℃ | 收集气体体积/mL | 所需时间/s |
① | 30 | 5 | 0 | 85 | 2 | 3.8 |
② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验和能证明物质D的用量越大,反应速率越快。
(6)写出步骤①中发生反应的化学方程式:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸与二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。先将一定量的二氧化锰溶解在200mL浓盐酸中,当反应生成8.96L(标况下)Cl2时,测得剩余溶液中盐酸的浓度为2mol/L(假设反应前后溶液的体积不变)。回答下列问题:
MnCl2+Cl2↑+2H2O。先将一定量的二氧化锰溶解在200mL浓盐酸中,当反应生成8.96L(标况下)Cl2时,测得剩余溶液中盐酸的浓度为2mol/L(假设反应前后溶液的体积不变)。回答下列问题:
(1)盐酸在反应中表现出的性质为___________________。
(2)写出上述制取Cl2的离子方程式:______________________________ 。
(3)计算反应耗用MnO2的质量为_________g,被氧化的HCl的物质的量为______ mol,起始HCl的物质的量浓度为____________mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知20°C时AgBr的溶解度为8.4×10﹣6AgCl的溶解度为1.5×10﹣4将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓硝酸银,发生的反应为( )
A.AgCl沉淀多于AgBr沉淀
B.AgCl和AgBr沉淀等量生成
C.AgCl沉淀少于AgBr沉淀
D.只有AgBr沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钙的活动性介于钠和钾之间(钙的密度为1.54克/厘米3),下列叙述正确的是
A.少量的钙储存在煤油B.氧化性:K+>Ca2+>Na+
C.钙可以从K2SO4溶液中置换出钾D.钙与水反应生成氢氧化钙和氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁矿石中含铁量的测定,按以下步骤进行:铁矿石中含铁量的测定
下列说法不正确的是( )
A.步骤④中煮沸的作用是为了除去残留的氯气
B.步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶
C.铁矿石中铁的百分含量为56%
D.该铁矿石中若含氧为24% ,则铁的氧化物的化学式为Fe2O3·3FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为1.0molL﹣1的NH3H2O和NH4Cl混合溶液10mL,测得其pH为9.3.下列有关叙述正确的是( )
A.加入适量的NaCl,可使c(NH4+)=c(Cl﹣)
B.滴加几滴浓氨水,c(NH4+)减小
C.滴加几滴浓盐酸, ![]() 的值减小
的值减小
D.1.0 molL﹣1的NH4Cl溶液中c(NH4+)比该混合溶液大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,向1L 0.1molL﹣1 CH3COOH溶液中加入0.1mol CH3COONa固体,则醋酸的电离平衡向 (填“正”或“逆”)反应方向移动;溶液中![]() 的值 (填“增大”、“减小”或“不变”).
的值 (填“增大”、“减小”或“不变”).
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3H2O.已知:
a.常温下,醋酸和NH3H2O的电离平衡常数均为1.74×10﹣5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.
则CH3COONH4溶液呈 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈 性,NH4HCO3溶液中物质的量浓度最大的离子是 (填化学式).
(3)99℃时,Kw=1.0×10﹣12 , 该温度下测得0.1molL﹣1 Na2A溶液的pH=6.
①H2A在水溶液中的电离方程式为 .
②该温度下,将0.01molL﹣1 H2A溶液稀释到20倍后,溶液的pH= .
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气 .
A.盐酸多 B.H2A多
C.一样多 D.无法确定
④将0.1molL﹣1 H2A溶液与0.2molL﹣1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com