
【题目】铁矿石中含铁量的测定,按以下步骤进行:铁矿石中含铁量的测定
下列说法不正确的是( )
A.步骤④中煮沸的作用是为了除去残留的氯气
B.步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶
C.铁矿石中铁的百分含量为56%
D.该铁矿石中若含氧为24% ,则铁的氧化物的化学式为Fe2O3·3FeO
【答案】C
【解析】A.向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸后可以降低氯气的溶解度,赶走溶液中溶解的过量的Cl2 , 不符合题意;
B.将原溶液稀释到250mL,需要使用的玻璃仪器仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶,不符合题意;
C.加入KI发生氧化还原反应:2Fe3++2I-=2Fe2++I2 , n(Fe3+)=n(I-)=0.50mol/L×0.02L×250/20=0.125mol,则铁矿石中铁的百分含量为(0.125mol×56g÷10.0)×100%=70%,符合题意;
D.该铁矿石中若含氧为24%,Fe的质量分数是70%,铁的质量分数是70%,氧元素的质量分数是24%,所以100g铁矿石中,铁元素的质量是70g,氧元素质量是24g,铁元素和氧元素的物质的量比为: (70g÷56g/mol):(24g÷16g/mol)=5:6,则铁的氧化物的化学式用氧化物的形式表示为Fe2O3·3FeO,不符合题意。
所以答案是:C
【考点精析】本题主要考查了配制一定物质的量浓度的溶液的相关知识点,需要掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3﹣、Cl﹣、NO | 不能大量共存, |
B | 由水电离出的H+浓度为1×10﹣12molL﹣1 | NH4+、Na+、NO | 一定能大量共存,NH4++H2ONH3H2O+H+ |
C | pH=1的溶液 | Fe2+、Al3+、SO | 不能大量共存,5Fe2++MnO4﹣+8H+═Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO﹣、SO | 不能大量共存,2ClO﹣+SO2+H2O═2HClO+SO |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列哪组物质进行实验
A. Cu、FeCl2溶液、MgCl2溶液
B. Fe、Cu、MgCl2溶液
C. Mg、CuO、FeSO4溶液
D. Fe、CuSO4溶液、MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中不正确的是( )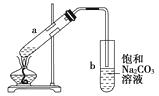
A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B.试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象
C.实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率
D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组拟采用苯酚和化合物B为主要物质合成有机中同体M(C16H14O4)。
已知:I.R—COOH ![]() R—CHO;
R—CHO;
Ⅱ.经红外光谱检测研究确认,有机物M含有2个“C-O-C”结构。且1molM与足量的银氨溶液反应能生成4molAg。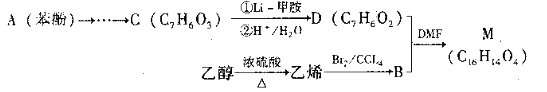
(1)有机物B中含有的官能团名称是。
(2)有机物B在X溶液作用下可生成乙二醇,则X为 (填化学式)。
(3)有机物C分子苯环上有两个对位的取代基,写出有机物C的结构简式_。
(4)①有机物D中不能发生的反应类型是。(选填序号,下同)
A.取代反应 b.消去反应 c加成反应 d氧化反应
②有机物Y与D互为同分异构体,写出符合下列条件的Y的结构简式。
i.含有苯环,苯环上的一卤代物有3种同分异构体
ⅱ.能与新制的氢氧化铜悬浊液反应产生砖红色沉淀
ⅲ.1molY最多能与2molNaOH溶液反应
(5)写出由有机物B与有机物D合成M的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关氧化还原反应的叙述正确的是( )
A.氧化还原反应的实质是电子的转移(得失或偏移)
B.氧化还原反应的实质是元素化合价的升降
C.氧化还原反应的实质是有氧元素的得失
D.物质所含元素化合价升高的反应是还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下22.4L氯气溶于水形成饱和溶液,发生反应过程转移电子数目为NA
B. 标准状况下,22.4LNO与11.2LO2混合后气体中分子总数等于NA
C. 将1L0.1mol/LFeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D. 常温下0.1 molOH—含NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫菜与海带类似,是一种富含生物碘的海洋植物;商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取。已知:
乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
密度/g·cm-3 | 0.789 3 | 1.595 | 0.71~0.76 | 4.94 |
沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
以下为某兴趣小组模拟从紫菜提取碘单质的过程。
![]()
粗产品
(1)实验室中焙烧紫菜用到的仪器有()(填写相应的字母)。
A.烧杯
B.表面皿
C.蒸发皿
D.坩埚
E.试管
F.酒精灯
G.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式
(3)操作①的名称是;试剂A为(填本题表格中一种最佳化学试剂的名称),不使用另外两种试剂的主要原因分别是:
①;
②。
(4)操作②中所用的主要玻璃仪器为 , 振荡、静置,应首先将分离出来。
(5)将下列装置图中缺少的必要仪器补画出来以最终将单质碘与试剂A分离。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com