
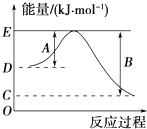
 下表列出了断裂某些化学键所需的能量:
下表列出了断裂某些化学键所需的能量:| 化学键 | H-H | Cl-Cl | I-I | O═O | O-H | H-Cl | H-I |
| 断裂1mol化学键所吸收的能量(kJ) | 436 | 247 | 151 | x | 463 | 431 | 299 |
| 1 |
| 2 |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| B、海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化 |
| C、缓解旱情的措施之一是可以用干冰或溴化银进行人工增雨 |
| D、针对甲型H1N1流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B、Cs和Ba分别位于第六周期ⅠA和ⅡA族,碱性:CsOH>Ba(OH)2 |
| C、硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D、由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤的干馏和石油的分馏均属化学变化 |
| B、BaSO4 在医学上用作钡餐,所以Ba2+对人体无毒 |
| C、14C可用于文物的年代鉴定,14C与12C互为同素异形体 |
| D、葡萄糖注射液不能产生丁达尔现象,不属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液中加过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
| B、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| C、氯气溶于水:Cl2+H2O?2H++Cl-+ClO- |
| D、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com