
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ______________________。
(2)①电解饱和食盐水的化学反应方程式为______________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生的离子方程式_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
【答案】BaCl2、NaOH、Na2CO3、HCl 2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH 防止MgCl2水解 Br2+SO2+2H2O=2Br-+4H++SO42- Cl2>Br2>SO2 3Br2+3CO32-═5Br-+BrO-3+3CO2↑ 蒸馏
Cl2↑+H2↑+2NaOH 防止MgCl2水解 Br2+SO2+2H2O=2Br-+4H++SO42- Cl2>Br2>SO2 3Br2+3CO32-═5Br-+BrO-3+3CO2↑ 蒸馏
【解析】
(1)除去Ca2+用Na2CO3、除去Mg2+用NaOH、除去SO42-用BaCl2;为了使杂质完全除去,所加除杂试剂必须过量,过量的除杂试剂成为新杂质,所以Na2CO3还用于除去过量的BaCl2,Na2CO3溶液必须在BaCl2溶液之后加入;过滤后加入稀盐酸除去过量的NaOH和Na2CO3。
(2)①电解饱和食盐水生成NaOH、H2和Cl2。
②MgCl2发生水解生成Mg(OH)2和HCl,HCl可防止MgCl2水解。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,涉及的反应有Cl2+2Br-=2Cl-+Br2、Br2+SO2+2H2O=H2SO4+2HBr;根据“同一氧化还原反应中,氧化性:氧化剂>氧化产物”比较氧化性强弱。
(4)Br2与Na2CO3溶液反应的化学方程式为3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑。加入CCl4萃取得到Br2的四氯化碳溶液,要获得单质Br2应用蒸馏法。
(1)除去Ca2+用Na2CO3、除去Mg2+用NaOH、除去SO42-用BaCl2;为了使杂质完全除去,所加除杂试剂必须过量,过量的除杂试剂成为新杂质,所以Na2CO3还用于除去过量的BaCl2,Na2CO3溶液必须在BaCl2溶液之后加入;过滤后加入稀盐酸除去过量的NaOH和Na2CO3;所加试剂及先后顺序为BaCl2、NaOH、Na2CO3、HCl(或NaOH、BaCl2、Na2CO3、HCl)。
(2)①电解饱和食盐水生成NaOH、H2和Cl2,反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
②若直接加热MgCl2·6H2O,MgCl2会发生水解:MgCl2+2H2O![]() Mg(OH)2+2HCl,加热时由于HCl的挥发使水解平衡正向移动,最终不能制得无水MgCl2;在HCl气氛中进行HCl会带走结晶水,防止MgCl2的水解,从而制得无水MgCl2。
Mg(OH)2+2HCl,加热时由于HCl的挥发使水解平衡正向移动,最终不能制得无水MgCl2;在HCl气氛中进行HCl会带走结晶水,防止MgCl2的水解,从而制得无水MgCl2。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,涉及的反应有Cl2+2Br-=2Cl-+Br2、Br2+SO2+2H2O=H2SO4+2HBr,用SO2吸收Br2的离子方程式为Br2+SO2+2H2O=4H++SO42-+2Br-。反应“Cl2+2Br-=2Cl-+Br2”中氧化剂为Cl2,氧化产物为Br2,同一氧化还原反应中,氧化性:氧化剂>氧化产物,则氧化性:Cl2>Br2;反应“Br2+SO2+2H2O=H2SO4+2HBr”中氧化剂为Br2,SO2为还原剂,氧化性:Br2>SO2;则Cl2、Br2、SO2的氧化性由强到弱的顺序为Cl2> Br2>SO2。
(4)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,Br2与Na2CO3溶液反应的化学方程式为3Br2+3Na2CO3=5NaBr+NaBrO3+3CO


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】将NaAlO2、Ba(OH)2、NaOH配成100.0 mL混合溶液,向该溶液中通入足量CO2,生成沉淀的物质的量n(沉淀),与通入CO2的体积(标准状况下)V(CO2)的关系,如下图所示,

下列说法中正确的是( )
A. P点的值为12.32
B. 混合溶液中c(NaOH)+c(NaAlO2)=4.0 mol/L
C. bc段的化学反应方程式为:NaOH+CO2=NaHCO3
D. cd段表示Al(OH)3沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为![]() ,溶质的质量分数为ω,溶质的物质的量浓度为C mol·L-1。则下列叙述中正确的是
,溶质的质量分数为ω,溶质的物质的量浓度为C mol·L-1。则下列叙述中正确的是
①![]() ②
②![]() ③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④向上述溶液中加入VmL C mol·L-1的稀盐酸,充分反应后溶液中离子浓度大小关系为:![]()
A. ②④ B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。
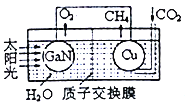
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。则下列说法中正确的是 ( )
⑴ 0.25 mol Na2O2中含有的阴离子数为0.5NA
⑵ 7.5 g SiO2晶体中含有的硅氧键数为0.5 NA
⑶ 标准状况下,2.24 L CCl4中含有的原子数为0.1 NA
⑷ 常温下,1 L 0.1 mol/L FeCl3溶液中含Fe3+数为0.1NA
⑸ 1 L 1 mol/LCH3COOH溶液中含有NA个氢离子
⑹ 常温下,2.7 g铝与足量的氢氧化钠溶液反应,失去的电子数为0.3NA
⑺ 22.4 L SO2气体,所含氧原子数为2NA
⑻ 14 g乙烯和丙烯的混合物中,含有共用电子对数目为3 NA
⑼ 25℃时,pH =13 的1.0 LBa(OH) 2 溶液中含有的OHˉ数为0.2NA
A. ⑵⑸⑻⑼ B. ⑵⑹⑻ C. ⑴⑷⑹⑻⑼ D. ⑴⑶⑸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某课外活动小组欲利用CuO与NH3的反应研究NH3的性质与分子组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为________________;仪器b中的试剂不能为下列中的____________(填字母)
A.氧化钙 B.碱石灰 C.石灰石 D.熟石灰
(2)装置B的作用是_______________
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管收集到无色无味的气体,写出装置C中发生反应的化学方程式_______________
(4)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________(用含m、n字母的代数式表示)
Ⅱ.铁是生产生活中常用金属
(1)写出铁与水蒸气的反应方程式______________________________。
(2)氯化亚铁溶液在空气中易被氧化,检验溶液是否变质所加试剂为___________(写化学式),向氯化亚铁溶液中加入烧碱溶液,现象为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室硫酸试剂标签上的部分内容,据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2mol/L
B. 1molAl与足量的该硫酸反应产生3g氢气
C. 配制500mL4.6 mol/L的稀硫酸需取该硫酸125mL
D. 将该硫酸加水配成质量分数49%的溶液时其物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验法是学习化学的重要方法。
Ⅰ.海带中含有丰富的碘元素,以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2I-+Cl2=2Cl-+I2,碘与溴一样易溶于有机溶剂):

(1)实验操作①的名称:___________________ 。
(2)实验步骤②中加适量Cl2的目的是______________________________。
(3)实验步骤③提取碘的过程中,不能选用的溶剂是________。
A.苯 B.酒精 C.四氯化碳
(4)从海藻开始经过5步操作到含碘的有机溶液的实验过程中,要用到多种实验仪器。已知实验室里有坩埚、坩埚钳、烧杯、玻璃棒、酒精灯、石棉网、以及必要的夹持仪器等物品,尚缺少的玻璃仪器是__________________、________________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出下图所示实验装置中的错误之处:_________________、_________________、__________________。

Ⅱ.某学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物:

填空和回答下列问题
(1)写出生成B物质的化学方程式________________
(2)滤液中的溶质有_____________________(写化学式),若要制得纯净的NaCl,应向滤液中加入适量的某种试剂,该试剂的名称是_________________ 。
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com