
【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。
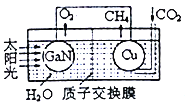
【答案】-12 kJ·mol-1 甲>乙=丙>丁 bd GaN+3H2O+OH-![]() NH3↑+Ga (OH)4- CO2+8H++8e-=CH4+2H2O 2:1 硫酸
NH3↑+Ga (OH)4- CO2+8H++8e-=CH4+2H2O 2:1 硫酸
【解析】
(1)①反应热=反应物总键能-生成物总键能,故△H=![]() = -12 kJ·mol-1;②反应CH3OH(g)+NH3(g)
= -12 kJ·mol-1;②反应CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H=-12 kJ·mol-1;为放热反应,以甲为参照,乙升高温度,反应向吸热反应的逆反应移动,CH3OH转化率减小;再以乙为参照,丙恒压时,由于反应正向进行时气体的量不变,平衡不移动,CH3OH转化率丙与乙相等;以乙为参照,丁中CH3OH增加的倍数大于氨气,故转化率降低,因此转化率大小关系为甲>乙=丙>丁;(2)①反应2Ga(s)+2NH3(g)
CH3NH2(g)+H2O(g)△H=-12 kJ·mol-1;为放热反应,以甲为参照,乙升高温度,反应向吸热反应的逆反应移动,CH3OH转化率减小;再以乙为参照,丙恒压时,由于反应正向进行时气体的量不变,平衡不移动,CH3OH转化率丙与乙相等;以乙为参照,丁中CH3OH增加的倍数大于氨气,故转化率降低,因此转化率大小关系为甲>乙=丙>丁;(2)①反应2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1为气体体积增大的放热反应;a.增大压强平衡逆向移动,故若纵轴a表示NH3的转化率,随着压强的增大转化率应该减小,故错误;b.增大压强平衡逆向移动,故纵轴a表示NH3的体积分数,则氨气的体积分数增大,故正确;c.正反应为放热反应,升高温度平衡逆向移动,氨气的体积分数减小,故T1>T2 ,故错误;d.升高温度平衡逆向移动,K值减小,A点温度大于C点,故KA<Kc,故正确。答案选bd;②镓的化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,反应的离子方程式为GaN+3H2O+OH-
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1为气体体积增大的放热反应;a.增大压强平衡逆向移动,故若纵轴a表示NH3的转化率,随着压强的增大转化率应该减小,故错误;b.增大压强平衡逆向移动,故纵轴a表示NH3的体积分数,则氨气的体积分数增大,故正确;c.正反应为放热反应,升高温度平衡逆向移动,氨气的体积分数减小,故T1>T2 ,故错误;d.升高温度平衡逆向移动,K值减小,A点温度大于C点,故KA<Kc,故正确。答案选bd;②镓的化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,反应的离子方程式为GaN+3H2O+OH-![]() NH3↑+Ga (OH)4-;(3)原电池中电子从负极流向正极,则铜电极为正极,正极上二氧化碳得电子生成甲烷,则铜电极表面的电极反应式为CO2+8H++8e-=CH4+2H2O;负极水失电子产生氧气,电极反应式为4H2O-8e-=2O2↑+8H+;两电极放出O2和CH4相同条件下的体积比为2:1;电解质溶液显酸性,必须加入酸,盐酸中的氯离子失电子产生氯气,应该选硫酸。
NH3↑+Ga (OH)4-;(3)原电池中电子从负极流向正极,则铜电极为正极,正极上二氧化碳得电子生成甲烷,则铜电极表面的电极反应式为CO2+8H++8e-=CH4+2H2O;负极水失电子产生氧气,电极反应式为4H2O-8e-=2O2↑+8H+;两电极放出O2和CH4相同条件下的体积比为2:1;电解质溶液显酸性,必须加入酸,盐酸中的氯离子失电子产生氯气,应该选硫酸。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】下列生活中常见物质主要成分的化学式表示正确的是( )
A.铁红—Fe2O3B.漂白粉—NaClO
C.生石灰—Ca(OH)2D.纯碱—NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法错误的是( )
A.少量的钠保存在煤油中
B.亚硫酸钠固体密封保存
C.保存氯化亚铁溶液时加入铜粉以防止氧化
D.浓硝酸保存在棕色试剂瓶中并置于冷暗处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计了如下装置进行试验探究,请回答下列问题:

(1)为准确读取量气管的读数,除视线应与量气管凹液面最低处向平,还应注意 。若考虑分液漏斗滴入烧瓶中液体的体积(假设其它操作都正确),则测得气体的体积将 (填“偏大”、“偏小”或“无影响”)。
(2)若在烧瓶中放入生铁,用此装置验证生铁在潮湿空气中发生吸氧腐蚀。
①通过分液漏斗向烧瓶中加入的试剂可选用下列 (填序号)
a.NaOH溶液 B.C2H5OH c.NaCl溶液 D.稀硫酸
②能证明生铁在潮湿空气中发生吸氧腐蚀的现象是 。
(2)若烧瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度。你认为此方法是否可行 (填“可行”或“不可行”,若填“不可行”请说明原因)。
(3)为探究MnO2在H2O2制取O2过程中的作用,将等量的H2O2加入烧瓶中,分别进行2次实验(气体体积在同一状况下测定):
序号 | 烧瓶中的物质 | 测得气体体积 |
实验1 | 20 mL H2O2,足量MnO2 | V1 |
实验2 | 20 mL H2O2,足量MnO2和稀硫酸 | V1<V2<2V1 |
若实验1中MnO2的作用是催化剂,则实验2中发生反应的化学方程式为 。
(4)若烧瓶中放入镁铝合金,分液漏斗内放NaOH溶液,分别进行四次实验,测得以下数据(气体体积均已换算成标准状况):
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
Ⅰ | 1.0 g | 10.00 mL | 346.30 mL |
Ⅱ | 1.0 g | 10.00 mL | 335.50 mL |
Ⅲ | 1.0 g | 10.00 mL | 346.00 mL |
Ⅳ | 1.0 g | 10.00 mL | 345.70 mL |
则镁铝合金中镁的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL 0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
D. 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ______________________。
(2)①电解饱和食盐水的化学反应方程式为______________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生的离子方程式_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对SO2的性质描述不正确的是( )
A. 无色、有刺激性气味的气体 B. 和水反应生成硫酸
C. 能使品红溶液褪色 D. 有还原性,能被氧气氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com