
【题目】关于如图所示化合物的说法不正确的是
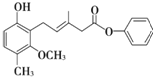
A. 该化合物既可以发生加成反应,又可以发生取代反应
B. 该化合物既可以与溴水反应,又可以使酸性KMnO4溶液褪色
C. 该化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
D. 1 mol该化合物最多可以与7 mol H2加成
【答案】C
【解析】
有机物的化学性质主要取决于其官能团,根据官能团的化学性质分析判断。
A项:该化合物分子中,苯环、碳碳双键都可与氢气等发生加成反应,酚羟基的邻位氢可与溴水取代反应,酯基的水解反应也是取代反应,A项正确;
B项:该化合物分子中,酚羟基的邻位氢可与溴水取代反应,碳碳双键可与溴水加成反应。酚羟基、碳碳双键、连在苯环上的甲基都可以使酸性KMnO4溶液褪色,B项正确;
C项:该化合物分子中有酚羟基,可与FeCl3溶液发生显色反应,但酚羟基酸性很弱,不能与NaHCO3溶液反应,C项错误;
D项:该化合物分子中,两个苯环和一个碳碳双键都能与氢气加成反应,1 mol该化合物最多可以与7 mol H2加成,D项正确。
本题选C。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G、H、I等全部由短周期元素组成的九种常见物质。已知:①其中只有B、C、F为单质,且常温常压下,B为固态,C、F为气态;②化合物中仅A、E为气态;③在常温下,D为淡黄色固体;④H的焰色反应呈黄色。它们的转化关系反应条件未注明如图所示:
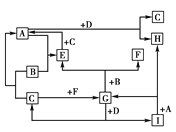
试回答:(1)写出下列物质的化学式:E________,F________,H________,I________。
(2)写出A与D反应的化学方程式:_______________。
(3)写出B与G反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向久置的氯水中滴入石蕊试液溶液,先变红后褪色
B.欲除去Cl2中少量HCl气体,将此混合气体通过盛饱和食盐水的洗气瓶
C.漂白粉有效成分是CaCl2和 Ca( ClO)2,应密封保存
D.实验有用MnO2和浓盐酸加热法制Cl2时,若有14.6gHCl参加反应,则可制得3.55gCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
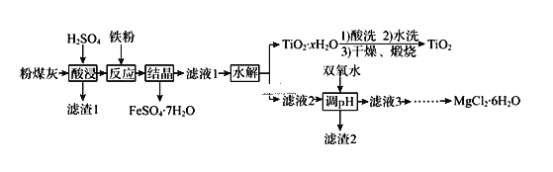
已知:①常温下,Ksp[Al(OH)3] ≈ 8.0×10-35;②滤液1中仍有Fe2+剩余③Fe3+完全沉淀时pH为3.7;Al3+完全沉淀时pH为5.0;Fe2+完全沉淀时pH为9.7;
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有_________(任写两种)。
(2)怎样判断TiO2xH2O沉淀已经洗涤干净________________________________。
(3)加入双氧水的目的是_____________________________________。滤渣2中的成分分别为Al(OH)3和_______________,Al(OH)3沉淀完全时(溶液中离子浓度小于10-5mol/L),溶液中的c(OH-)为________。
(4)将MgCl26H2O制成无水MgCl2时应注意__________________________________。
(5)某同学以石墨为两个电极,电解MgCl2溶液以制取金属镁。你认为他能否获得成功?_______。用化学方程式解释原因___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,D气体能使带火星的木条复燃,X是一种常见的酸式盐。
试填写下列空白:
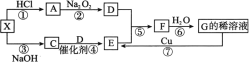
(1) 物质X的名称是___________;检验C气体的方法是___________。
(2) 反应④的化学方程式为___________。
(3) 反应⑥中氧化剂与还原剂的质量之比为___________;反应⑦中氧化剂与还原剂的物质的量之比为___________。
(4) 写出X与足量NaOH溶液反应的离子方程式:____________。
(5) 在标准状况下,在一个干燥的烧瓶内F和D的混合气体[V(F)∶V(D)=4∶1]。然后做喷泉实验,则烧瓶中所得溶液中溶质的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用混有硫酸亚铁和硫酸镁等杂质的锰矿(含MnO2、MnCO3)生产硫酸锰,实验室模拟生产过程如下:
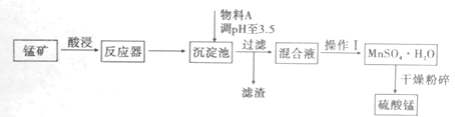
已知金属离子完全沉淀时的pH值如下:Fe3+:3.5;Fe2+:9.5;Mn2+:10.8;Mg2+:11.6。
(1)反应器中发生氧化还原反应的离子方程式是________。
(2)从经济效益考虑,物料A可以是________。
(3)硫酸锰和硫酸镁的溶解度曲线如右图所示:
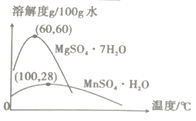
则操作Ⅰ包含的主要操作为________。
(4)MnSO4·H2O在1150℃条件下分解,产物是Mn2O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是

A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力大于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
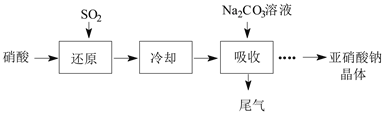
已知:Ⅰ.Na2CO3+NO+NO2=2NaNO2+CO2;Na2CO3+2NO2=NaNO2+NaNO3+CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是___(填元素符号)。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___。
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为___。
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00mL0.100mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL0.100mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度___(“偏大”、“偏小”或“无影响”),原因是___。
②通过计算,该样品中NaNO2的质量分数是___,可能含有的杂质有___(写出其中一种即可)。
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com