
【题目】下列说法正确的是( )
A.向久置的氯水中滴入石蕊试液溶液,先变红后褪色
B.欲除去Cl2中少量HCl气体,将此混合气体通过盛饱和食盐水的洗气瓶
C.漂白粉有效成分是CaCl2和 Ca( ClO)2,应密封保存
D.实验有用MnO2和浓盐酸加热法制Cl2时,若有14.6gHCl参加反应,则可制得3.55gCl2
【答案】B
【解析】
A.新制的氯水中,Cl2有一部分与水发生反应:Cl2+H2OHCl+HClO,而久置的氯水,由于HClO见光分解,溶液中HClO浓度逐渐减小,使Cl2与水的反应直至趋于完全,最终溶液将变为盐酸溶液,不含有HClO,有酸性而无漂白性,因此,向久置氯水中滴入石蕊试液,溶液只变红而不褪色,A错误;
B.将Cl2和HCl的混合气体通过入饱和食盐水中,HCl因易溶于水而被吸收掉,Cl2虽然能溶于水中,但由于饱和食盐水中Cl-浓度大,使Cl2与H2O反应受到抑制,从而减少了Cl2被水吸收的量,B正确;
C.Ca(ClO)2是漂白粉的有效成分,CaCl2不是,但为了避免漂白粉因与空气接触而变质,漂白粉应密封保存,C错误;
D.MnO2与浓盐酸反应生成Cl2:MnO2(浓)+4HCl![]() MnCl2+Cl2↑+2H2O,根据方程式,146gHCl能生成71g氯气,则14.6gHCl能生成氯气7.1g,D错误;
MnCl2+Cl2↑+2H2O,根据方程式,146gHCl能生成71g氯气,则14.6gHCl能生成氯气7.1g,D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式并用双线桥法表示电子转移的方向和数目:______________。
(2)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:________。
(3)工业上制漂白粉的化学方程式为____________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是_________。
(4)KAl(SO4)2·12H2O因其溶于水生成_____(化学式)可以吸附杂质,从而达到净水作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为CO(g)+2H2(g)=CH3OH(g) ΔH=-116kJ·mol-1。某些化学键的键能数据如表:
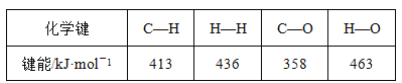
则CO中碳氧键的键能是
A.431kJ·mol-1B.946kJ·mol-1
C.1072kJ·mol-1D.1130kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)Ⅲ中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为_____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法不正确的是
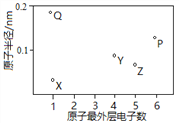
A. X与Q形成的化合物是离子化合物
B. X与Z的原子均含有1个未成对电子
C. Y与P形成的化合物YP2的分子空间构型是直线形
D. Q单质含有金属键,有自由移动的电子,因此可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是
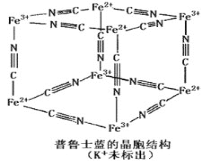
A. 化学式可以表示为KFe2(CN)6
B. 每一个立方体中平均含有24个π键
C. 普鲁士蓝不属于配位化合物
D. 每个Fe3+周围与之相邻的Fe2+离子有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“>”“=”或“<”)AsH3。
(3)N原子核外有______种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为_____。
(4)科学家通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为________。
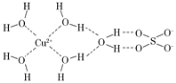
(5)As的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_______,Fe3+的配位数为______。
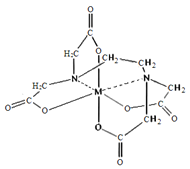
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示化合物的说法不正确的是
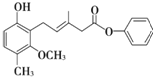
A. 该化合物既可以发生加成反应,又可以发生取代反应
B. 该化合物既可以与溴水反应,又可以使酸性KMnO4溶液褪色
C. 该化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
D. 1 mol该化合物最多可以与7 mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种蓝黑色(有时是粉红色)的固体,是一种由趋磁细菌制造的生物矿。某研究小组按如下流程探究该固体的组成:

请回答:
(1)已知化合物X中只含两种元素,则X中含有的元素是_____。
(2)请写出E反应生成F的化学方程式:_______________。
(3)化合物X与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不溶物和一种臭鸡蛋气味气体,请写出该反应的离子方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com