
【题目】化合物X是一种蓝黑色(有时是粉红色)的固体,是一种由趋磁细菌制造的生物矿。某研究小组按如下流程探究该固体的组成:

请回答:
(1)已知化合物X中只含两种元素,则X中含有的元素是_____。
(2)请写出E反应生成F的化学方程式:_______________。
(3)化合物X与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不溶物和一种臭鸡蛋气味气体,请写出该反应的离子方程式:_____________________。
【答案】 Fe、S H2SO3+H2O2![]() H2SO4+H2O Fe3S4+6H+
H2SO4+H2O Fe3S4+6H+![]() 3Fe2++S↓+3H2S↑
3Fe2++S↓+3H2S↑
【解析】溶液B中加入KSCN溶液得血红色溶液C,说明溶液B中含有Fe3+,红棕色固体A加入盐酸得溶液B,则A为Fe2O3,刺激性气味气体D与水反应得无色酸性溶液E,加入H2O2得无色溶液F且酸性增强,说明D为SO2,E为H2SO3溶液,F为H2SO4溶液,化合物X在足量的空气中煅烧得Fe2O3和SO2,已知化合物X中只含两种元素,则化合物X中含有Fe和S元素,n(Fe2O3)=7.2g÷160g/mol=0.045mol,则n(Fe)=2×0.045mol=0.09mol,所以8.88g化合物X中n(S)=(8.88g-0.09mol×56g/mol)÷32g/mol=0.12mol,n(Fe): n(S)=0.09mol:0.12mol=3:4,则X的化学式为Fe3S4。
(1). 根据上述分析可知,X中含有的元素为Fe和S,故答案为:Fe、S;
(2). H2SO3和H2O2发生氧化还原反应生成H2SO4和H2O,反应方程式为:H2SO3+H2O2=H2SO4+H2O,故答案为:H2SO3+H2O2=H2SO4+H2O;
(3). 化合物Fe3S4与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不溶物和一种臭鸡蛋气味气体,说明反应产物为Fe2+、S和H2S,根据得失电子守恒和原子守恒,该反应的离子方程式为:Fe3S4+6H+=3Fe2++S↓+3H2S↑,故答案为:Fe3S4+6H+=3Fe2++S↓+3H2S↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某元素的一种核素X 的质量数为A,含N个中子,它与1H 原子组成HmX 分子。在a g HmX中所含质子的物质的量是
A. ![]() mol B.
mol B. ![]() mol
mol
C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下图是某同学设计的测定中和热的实验装置。

(1)强酸与强碱中和反应的实质,可用离子反应表示为________。 装置中使用碎泡沫塑料的目的是_________。
(2) 实验时,同学先分别在50mL烧杯中,各加入20mL 2mol/L的盐酸和20mL2mol/L的NaOH溶液,分别测其温度,分别测其温度的目的是________。
Ⅱ、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(3)反应开始至2min,以气体Z表示的平均反应速率为_________.
(4)该反应的化学方程式为_________.
(5)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:此时体系的压强是开始时的_________倍;达平衡时,容器内混合气体的平均相对分子质量比起始投料时_________(填"增大""减小"或"相等").
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B. 将体积增大为原来的2倍,再次达到平衡时,气体的密度变大
C. 因CaCO3(s)需加热条件才分解生成CaO(s)和CO2(g),所以是△H<0
D. 保持容器压强不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:D为烃;E分子中碳元素与氢元素的质量之比6∶1,相对分子质量为44,其燃烧产物只有CO2和H2O。A的最简式与F相同,且能发生银镜反应,可由淀粉水解得到。

(1)A的结构简式为__________________。
(2)写出D→E的化学方程式:_______________________。
(3)下列说法正确的是____。
A.有机物F能使石蕊溶液变红
B.用新制的氢氧化铜无法区分有机物C、E、F的水溶液
C.等物质的量的C和D分别完全燃烧消耗氧气的量相等
D.可用饱和碳酸钠溶液除去有机物B中混有的少量C、F
E. B的同分异构体中能发生银镜反应的酯类共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数值为NA,下列说法中正确的是
A. 一定条件下3.2gSO2与足量O2反应转移电子数为0.1NA
B. 2.9g异丁烷和正丁烷混合物含有C-H键数目为0.5NA
C. 50mL12mol/L浓盐酸与足量MnO2共热转移电子数0.3NA
D. 标准状况下,3.36L三氯甲烷中含有氯原子0.45NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铅蓄电池填料(主要成分为PbO2、PbO、PbSO4等)作阴极,采取固相直接电解法可提取金属Pb,其装置如图所示(已知:PbSO4+3OH-=HPbO2-+S042-+H2O)。下列说法中错误的是

A. b与外接电源的负极相连
B. PbO2放电时电极反应式为:PbO2+4e-+2H2O=Pb+40H-
C. 电解过程中左室水的电离程度减弱(忽略溶液温度变化)
D. 与传统无膜电解法相比,该电解方法可提高铅元素利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率;
(3)2 min末SO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠样品中含有少量的杂质Na2SO4,按下列流程进行净化,流程中的( )中是合适的试剂,在[ ]中是实验操作名称。写出有关反应的化学方程式:
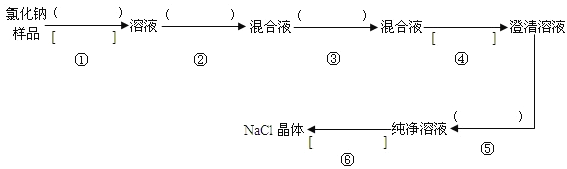
(1)操作①、②、③、⑤中所需加入试剂分别为_______、______、______、_____。
(2)操作①、④、⑥的操作名称分别为_________、_______、_______。
(3)写出有关的离子反应方程式:
第②步:_____________________________。
第⑤步:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com