
����Ŀ��������ͼ��ijͬѧ��ƵIJⶨ�к��ȵ�ʵ��װ�á�

��1��ǿ����ǿ���кͷ�Ӧ��ʵ�ʣ��������ӷ�Ӧ��ʾΪ________�� װ����ʹ������ĭ���ϵ�Ŀ����_________��
��2�� ʵ��ʱ��ͬѧ�ȷֱ���50mL�ձ��У�������20mL 2mol/L�������20mL2mol/L��NaOH��Һ���ֱ�����¶ȣ��ֱ�����¶ȵ�Ŀ����________��
��ij�¶�ʱ,��һ��2L���ܱ�������,X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ.����ͼ���������:

��3����Ӧ��ʼ��2min,������Z��ʾ��ƽ����Ӧ����Ϊ_________.
��4���÷�Ӧ�Ļ�ѧ����ʽΪ_________.
��5����X��Y��Z��Ϊ����,2min��Ӧ�ﵽƽ��,��Ӧ��ƽ��ʱ:��ʱ��ϵ��ѹǿ�ǿ�ʼʱ��_________��;��ƽ��ʱ,�����ڻ�������ƽ����Է�����������ʼͶ��ʱ_________(��"����""��С"��"���").
���𰸡�H+��aq��+OH-(aq)=H2O(l) ������������ʧ����������Һ�ij�ʼ�¶ȵ�ƽ��ֵ0.05 mol��L-1��min-13X+Y2Z0.9����
��������
��.��1��ǿ����ǿ���кͷ�Ӧ��ʵ���������Ӻ����������ӷ����кͷ�Ӧ����ˮ�����ڸ�ʵ��ⶨ�ķ�Ӧ�������仯�����ʵ���о����ܱ���ʵ����ʧ��
��2����ʵ����Ҫ��¼��Ӧǰ����ϵ���¶ȱ仯�����ʵ��ʱ���ֱ�������NaOH��Һ���¶ȣ���Ŀ���Ǽ���������Һ�ij�ʼ�¶ȵ�ƽ��ֵ��
��.��1�����ݹ�ʽ����ʽV= ![]() ���м��㷴Ӧ���ʡ�
���м��㷴Ӧ���ʡ�
��2���������ߵı仯�����жϷ�Ӧ���������,�������ʵ����仯֮�ȵ��ڻ�ѧ������֮����д����ʽ��
��3������ͬ�¶���,��������ʵ���֮�ȵ���ѹǿ֮�Ƚ��м��㣻���ݹ�ʽ![]() =m(��)/n(��)�����ж���
=m(��)/n(��)�������
��.��1��ǿ����ǿ���кͷ�Ӧ��ʵ���������Ӻ����������ӷ����кͷ�Ӧ����ˮ�����ӷ�Ӧ��ʾΪH+��aq��+OH-(aq)=H2O(l)�����ڸ�ʵ��ⶨ�ķ�Ӧ�������仯�����װ����ʹ������ĭ���ϵ�Ŀ���Ǽ�����������ʧ����ȷ�𰸣�H+��aq��+OH-(aq)=H2O(l)��������������ʧ��
��2�� ��ʵ����Ҫ��¼��Ӧǰ����ϵ���¶ȱ仯�����ʵ��ʱ���ֱ�������NaOH��Һ���¶ȣ���Ŀ���Ǽ���������Һ�ij�ʼ�¶ȵ�ƽ��ֵ����ȷ��������������Һ�ij�ʼ�¶ȵ�ƽ��ֵ��
��.��1����Ӧ��ʼ��2min, Z�仯��0.2 mol��������Z��ʾ��ƽ����Ӧ����Ϊ0.2/(2��2)=0.05 mol��L-1��min-1����ȷ�𰸣�0.05 mol��L-1��min-1��
(2)�ﵽƽ��״̬ʱ,�μӷ�Ӧ��X�ı仯��Ϊ1.0-0.7=0.3mol��Y�ı仯��Ϊ1.0-0.9=0.1mol��Z�仯��0.2 mol��ͬһ��Ӧ��ͬһʱ����ڲμӷ�Ӧ�ĸ����ʵ����ʵ���֮�ȵ����������֮��,����X��Y��Z�ļ�����֮�ȣ�0.3:0.1:0.2=3:1:2,���Ը÷�Ӧ����ʽΪ3X+Y2Z,������ȷ��: 3X+Y2Z��
(3)����ͼ��֪,δ��Ӧʱ�����������ʵ���=(1.0+1.0)=2.0mol,ƽ��״̬����������ʵ���=(0.9+0.7+0.2)=1.8mol,���º���������,��������ʵ���֮�ȵ�����ѹǿ֮��,����ƽ��״̬��ϵѹǿ�ǿ�ʼʱ��1.8/2=0.9������Ϊ�������������,�����ʵ�������,����![]() =m(��)/n(��)��֪����ƽ����Է�������������ȷ��:0.9������
=m(��)/n(��)��֪����ƽ����Է�������������ȷ��:0.9������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ơ��ؼ��ƼغϽ𣬶������������۵�ߵͱȽ���ȷ����( )
A.�ƼغϽ��ƣ���B.�ƣ��أ��ƼغϽ�
C.�ƣ��ƼغϽ𣾼�D.�أ��ƼغϽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N��P��As��Ga��Cr��Cu��Ԫ�ػ���������࣬������Ҫ���о���ֵ��Ӧ�ü�ֵ����ش��������⣺
��1��CrԪ�ؼ۵����Ų�ʽΪ__________________��
��2��N2F2�����У���ԭ�ӵ��ӻ��������Ϊ_______������N2F2���ܵĽṹʽ_____��
��3��PCl3��PCl5����Ԫ���γɵ�������Ҫ���������ݼ۵��ӻ��������Ʋ�PCl3�Ŀռ乹��__________________��
��4���黯���Ե������뵼�����ƣ��۵�Ϊ1230�棬���пռ���״�ṹ�����ܱȹ���������㷺�����״���Ӽ�������������ǡ�����ɴ��ȼ�˼����С�
���黯������____���塣��֪���������黯������ͬ�־������͡������־����۵�ϸߵ���___���ѧʽ������������____���������־����е�����Ԫ�ص縺����С����_____����Ԫ�ط��ţ���
��5��ͭ�Ļ���������ܶ࣬��ͼ���Ȼ���ͭ�ľ����ṹ����֪�������ⳤΪa cm�����⻯��ͭ�ܶȵļ���ʽΪ��=_______g/cm3.(��NA��ʾ����ӵ�����)
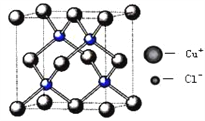
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2(g)��F2(g) ===2HF(g) ��H����270 kJ��mol��1������˵����ȷ����
A. ����ͬ�����£�1 mol H2(g)��1 mol F2(g)�������ܺ�С��2 mol HF(g)������
B. 1 mol H2(g)��1 mol F2(g)��Ӧ����2 molҺ̬HF�ų�����������270 kJ
C. �÷�Ӧ���淴Ӧ�Ƿ��ȷ�Ӧ
D. �÷�Ӧ���̵������仯������ͼ����ʾ
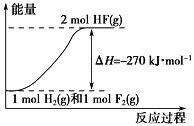
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������д������( )
A.����Ũ���ᡢŨ���Ṳ�Ȳ�����50��60 �淴Ӧ����������
B.����ϩ(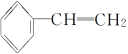 )�ں��������´�����������һ�������(
)�ں��������´�����������һ�������( )
)
C.��ϩ��������Ȼ�̼��Һ��Ӧ����1,2��������
D.�ױ�(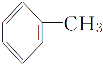 )�������ڹ��������·�Ӧ��Ҫ����2,4���ȼױ�(
)�������ڹ��������·�Ӧ��Ҫ����2,4���ȼױ�( )
)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ������Ҫ����0.1 mol��L��1NaOH��Һ500mL��
��1�����ݼ�����������ƽ��ȡ������Ϊ__________g������ͼ��ʾ�����У�����������Һ�϶�����Ҫ����_________(�����)����ͼ�����������⣬����������Һ����Ҫ�IJ���������________��
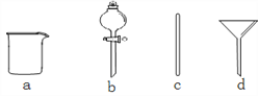
��2������ʱ������ȷ�IJ���˳����(����ĸ��ʾ��ÿ������ֻ��һ��)__________��
A��������ˮϴ���ձ�2�Ρ�3�Σ�ϴ��Һ��ע������ƿ����
B����ʢ��NaOH������ձ��м�������ˮ�ܽ�
C�����ձ�������ȴ����Һ�ز�����ע������ƿ��
D��������ƿ�ǽ����������µߵ���ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1 cm��2 cm��
��3����������������NaOH��ҺŨ��ƫ�ߵ���_____��
A���ܽ����Һû����ȴ�����¾�ת��
B��ת��ʱû��ϴ���ձ���������
C��������ƿ��ˮ����ʱ�۾�����Һ��
D��ҡ�Ⱥ���Һ����ڿ̶��ߣ��ּ�����ˮ���̶���
II����Ũ����ȡ������Ϊ100 mL��A��B����NaOH��Һ�У��ֱ�ͨ��һ������CO2������������Һ�еμ�0.1 mol/L���ᣬ����CO2�����(��״��)����������������ϵ��ͼ��ʾ��
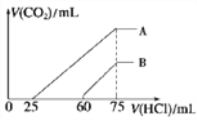
��4����A���߱�����ԭ��Һͨ��CO2���������������ᷴӦ����CO2����������________mL(��״��)��
��B���߱�����ԭ��Һͨ��CO2��������Һ�����ʵĻ�ѧʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A. ̫���ܵ�ؿ��ù������������Ӧ�������ڻ���������
B. SiO2������������ά
C. Na2SiO3ˮ��Һ�׳�ˮ������������ľ�ķ������𤽺��
D. ������Ͽ���ʹ���˴���ˮ�࣬ˮ�����л�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X��һ������ɫ(��ʱ�Ƿۺ�ɫ)�Ĺ���,��һ��������ϸ������������ij�о�С�鰴��������̽���ù�������:

��ش�:
��1����֪������X��ֻ������Ԫ��,��X�к��е�Ԫ����_____��
��2����д��E��Ӧ����F�Ļ�ѧ����ʽ:_______________��
��3��������X�����ᷴӦ,��Ӧ��õ�dz��ɫ��Һ,ͬʱ����һ��dz��ɫ�������һ�ֳ�������ζ����,��д���÷�Ӧ�����ӷ���ʽ:_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˾ƥ����һ����ʷ�ƾõĽ�����ʹҩ����Ԥ��Ѫ˨���Թ��кܺõ����ã�M��һ�ַ�ɹ�������ǵĽṹ��ʽ�ֱ�Ϊ
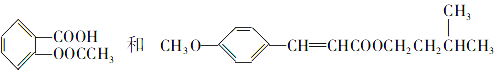 ��
��
���ǵĺϳ�·�����£�

��֪����. E���׳�ˮ���ᣬѧ��2-�ǻ�������

IV������ͬϵ���������ķ�Ӧ��ѭ�����ڱ����������ڲ�������
����������Ϣ�ش���������
��1����˾ƥ���й����ŵ�����Ϊ______
��2�� B��D���̵ķ�Ӧ����Ϊ______��д��C��I�Ľṹ��ʽ________________
��3����E��F�Ĺ��������۷�Ӧ���ù��̻�ѧ����ʽΪ_________
��4�����й��ڰ�˾ƥ�ֺͷ�ɹ��M˵����ȷ����_________(˫ѡ)
A.M�ķ���ʽ��C15H20O3
B.���а�˾ƥ�ֲ��ܷ���������Ӧ
C.1mol��˾ƥ����ȫˮ�⣬������2molNaOH
D.1molM���������������ӳɷ�Ӧ���������4molH2
��5����˾ƥ���ж���ͬ���칹�壬��д��ͬʱ������������������һ��ͬ���칹��Ľṹ��ʽ________
��.��������2��ȡ����;
��.�ܷ���ˮ�ⷴӦ���ܷ���������Ӧ��������NaHCO3����CO2
iii.�˴Ź���������5��壬�����֮��Ϊ1:1:2:2:2
��6��д����I��M�ĺϳ�·��(��һ���Ѹ���)���ϳ�·��ʾ�����£�
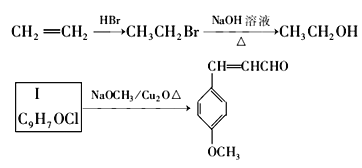 __________________________
__________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com