

| A、该反应的化学方程式为A+3B?2C |
| B、在tls时,v(A)正=0 |
| C、(t1+l0)s时再充入0.4 molA和0.25 mol B,反应物A的转化率增大 |
| D、若该反应在绝热容器中进行,也在tl时刻达到平衡 |
| 0.42 |
| 0.23×0.3 |
| 200 |
| 3 |
| 0.42 |
| 0.63×0.55 |


科目:高中化学 来源: 题型:
| A、1 mol?L-1甲酸溶液的pH约为2 |
| B、甲酸能与水以任意比例互溶 |
| C、10mL 1 mol?L-1甲酸恰好与10mL 1 mol?L-1NaOH溶液完全反应 |
| D、在相同条件下,甲酸溶液的导电性比醋酸溶液强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
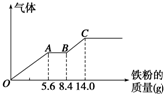 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )A、原混合酸中NO
| ||
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | ||
| C、第二份溶液中最终溶质为FeSO4 | ||
| D、H2SO4浓度为1.25 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 实验现象 | 结论 |
| A | 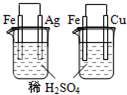 烧杯中银表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Fe>Cu>Ag |
| B |  边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C |  淡黄色固体先变为白色,后变为黑色 | 溶解性:AgCl>AgBr>Ag2S |
| D | 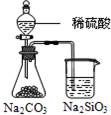 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:S>C>Si |
| A、A | B、B | C、B | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 可用于探究NH4HCO3的热稳定性 |
B、 可用于收集H2、CO2 |
C、 X若为CCl4,可用于吸收氨气或氯化氢,并能防倒吸 |
D、 可用于干燥、收集NH3,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
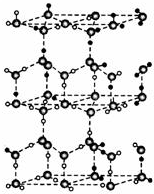 水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.
水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体--冰.其结构示意如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com