
| A、1 mol?L-1甲酸溶液的pH约为2 |
| B、甲酸能与水以任意比例互溶 |
| C、10mL 1 mol?L-1甲酸恰好与10mL 1 mol?L-1NaOH溶液完全反应 |
| D、在相同条件下,甲酸溶液的导电性比醋酸溶液强 |


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| A、6A% | ||
B、
| ||
| C、10A% | ||
D、(100-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
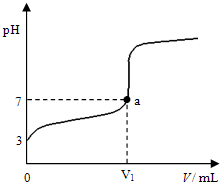 某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )
某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )| A、该温度下醋酸的电离平衡常数约为1×10-5mol?L-1 |
| B、图中V1>20mL,且a点对应的溶液中:c (Na+)+c (H+)=c (OH-)+c (CH3COO-) |
| C、图中V1<20mL,且a点对应的溶液中:c (CH3COOH)+c (CH3COO-)>c (Na+) |
| D、当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH)+c (H+)>c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl电离产生H+和Cl-,可判断HCl分子中存在离子键 |
| B、Na2O2固体中含有的阴离子与阳离子的个数比为1:1 |
| C、化学键是指使原子或离子相互结合的作用力 |
| D、不同元素组成的多原子分子中的化学键一定全是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该反应的化学方程式为A+3B?2C |
| B、在tls时,v(A)正=0 |
| C、(t1+l0)s时再充入0.4 molA和0.25 mol B,反应物A的转化率增大 |
| D、若该反应在绝热容器中进行,也在tl时刻达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com