

| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 用该硫酸配制稀硫酸时必须用到托盘天平 | |
| C. | 配制200mL 4.6mol/L的稀硫酸需量取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol•L-1 |
分析 A.根据c=$\frac{1000ρω}{M}$计算该硫酸溶液的物质的量浓度;
B.硫酸为液态,用量筒量取,不需要使用托盘天平;
C.根据溶液稀释前后溶质的物质的量不变分析.
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,据此判断.
解答 解:A.该硫酸溶液的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B.硫酸为液态,不需要托盘天平,应该用量筒量取浓硫酸,故B错误;
C.设配制200mL4.6mol•L-1的稀硫酸需取该硫酸的体积为xL,根据溶液稀释前后溶质的物质的量不变可知:0.20L×4.6mol/L=x×18.4mol/L,解得:x=0.05L=50mL,故C正确;
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,所得溶液的物质的量浓度小于9.2mol/L,故D错误;
故选C.
点评 本题考查物质的量浓度的有关计算,题目难度不大,明确物质的性质、溶液稀释特点等知识点即可解答,易错选项是D,浓硫酸浓度越大其密度越大,氨水浓度越大其密度越小.


科目:高中化学 来源: 题型:选择题
| A. | 反应中转移电子1.0mol | B. | 产生NO2气体0.26mol | ||
| C. | 原HNO3浓度为8.0mol/L | D. | 原HNO3浓度为6.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: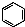 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$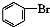 +HBr +HBr | |
| B. | 蛋壳溶于食醋:CaCO3+CH3COOH=CH3COOCa+H2O+CO2↑ | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH$\stackrel{△}{→}$CH2=CH2+NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1 L 1 mol/L 的NaCl溶液中取出10 mL,其浓度仍是1 mol/L | |
| B. | 制成0.5 L 10 mol/L 的盐酸,需要氯化氢气体 112L(标准状况) | |
| C. | 0.5 L 2 mol/L BaCl2 溶液中,Ba2+ 和Cl- 总数位3×6.02×1023 | |
| D. | 10 g 98% 硫酸 (密度为 1.84g/cm3)与10 mL 18.4 mol/L 硫酸的浓度是不同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
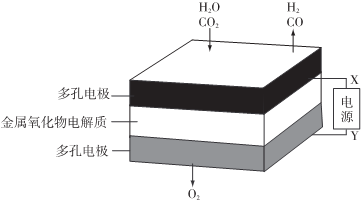
| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
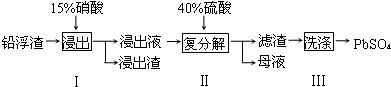
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其分子结构呈三角形 | B. | 分子中不存在孤对电子 | ||
| C. | 它的沸点比三氯化磷沸点低 | D. | 三氯化氮水解有硝酸生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com