
| A. | 反应中转移电子1.0mol | B. | 产生NO2气体0.26mol | ||
| C. | 原HNO3浓度为8.0mol/L | D. | 原HNO3浓度为6.0mol/L |
分析 铜在反应中失去2个电子,所以转移电子是0.51 mol×2=1.02 mol,
令NO和NO2的物质的量分别为x mol、ymol,根据电子转移守恒及二者体积列方程计算各自物质的量;
向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH),根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO),再根据c=$\frac{n}{V}$计算原硝酸的浓度.
解答 解:A、铜在反应中失去2个电子,所以转移电子是0.51 mol×2=1.02 mol,故A错误;
B、NO和NO2混合气体在标准状况下的体积为11.2L,混合气体物质的量为$\frac{11.2L}{22.4L/mol}$,令NO和NO2的物质的量分别为x mol、ymol,根据电子转移守恒及二者体积,则:$\left\{\begin{array}{l}{x+y=0.5}\\{3x+y=0.51×2}\end{array}\right.$,解得x=0.26 y=0.24
即混合气体中NO为0.26mol、NO2为0.24mol,故B错误;
C、向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH)=0.3L×5mol/L=1.5 mol,
根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO)=1.5 mol+0.5mol=2mol,
故原有硝酸的物质的量浓度为$\frac{2mol}{0.25L}$=8.0mol/L,故C正确;
D、由C中解析可知,原有硝酸的物质的量浓度为$\frac{2mol}{0.25L}$=8.0mol/L,故D错误;
故选C.
点评 本题考查硝酸的性质、化学计算,侧重于学生的分析能力和计算能力的考查,难度中等,注意利用原子守恒进行的计算.


科目:高中化学 来源: 题型:多选题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、A13+、H+、Cl- | ||
| C. | NO3-、NH4+、K+、Cl- | D. | NO3-、K+、AlO2-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水中有下列平衡Cl2+H2O═HCl+HClO,当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 氨水中加入NaOH固体有利于氨气的溢出 | |
| D. | pH=1的盐酸加水稀释到原体积的100倍后,PH=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.5% | B. | 9.1% | C. | 8% | D. | 5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4+H2S═CuS↓+H2SO4 | |
| B. | 2FeCl3+Cu═2FeCl2+CuCl2 | |
| C. | .Cu2 (OH)2CO3 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O | |
| D. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S与Cu反应:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | 酸雨放置过程中pH变小:2H2SO3+O2═2H2SO4 | |
| C. | 亚硫酸氢钙溶液与澄清的石灰水混合:Ca2++HSO3-+OH-═CaSO3↓+H2O | |
| D. | 向Na2S和Na2SO3的混合溶液中滴加稀H2SO4[n(Na2S):n(Na2SO3)=2:1]:2S2-+SO32-+6H+═3S↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,它可以跟强碱反应,但是不能与任何酸反应 | |
| B. | 根据SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑的反应,可推知硅酸酸性比碳酸强 | |
| C. | 二氧化碳气体通入硅酸钠溶液中可以制得硅酸 | |
| D. | 二氧化硅对应的水化物只有H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
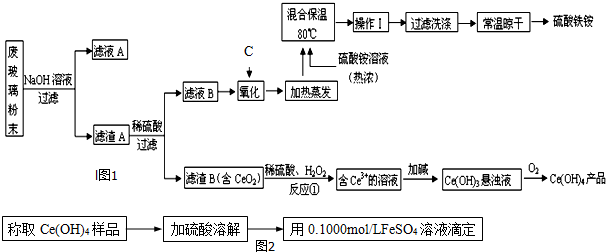
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 用该硫酸配制稀硫酸时必须用到托盘天平 | |
| C. | 配制200mL 4.6mol/L的稀硫酸需量取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com