
| A. | S与Cu反应:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | 酸雨放置过程中pH变小:2H2SO3+O2═2H2SO4 | |
| C. | 亚硫酸氢钙溶液与澄清的石灰水混合:Ca2++HSO3-+OH-═CaSO3↓+H2O | |
| D. | 向Na2S和Na2SO3的混合溶液中滴加稀H2SO4[n(Na2S):n(Na2SO3)=2:1]:2S2-+SO32-+6H+═3S↓+3H2O |
分析 A.硫与铜反应生成硫化亚铜;
B.亚硫酸不稳定容易被氧化生成硫酸;
C.二者反应生成亚硫酸钙和水;
D.二者在酸性环境下发生氧化还原反应生成硫单质和水.
解答 解:A.S与Cu反应,化学方程式:Cu+2S$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S,故A错误;
B.酸雨放置过程中pH变小是因为亚硫酸不稳定容易被氧化生成硫酸,化学方程式:2H2SO3+O2═2H2SO4,故B正确;
C.亚硫酸氢钙溶液与澄清的石灰水混合,离子方程式:Ca2++HSO3-+OH-═CaSO3↓+H2O,故C正确;
D.向Na2S和Na2SO3的混合溶液中滴加稀H2SO4[n(Na2S),离子方程式:n(Na2SO3)=2:1]:2S2-+SO32-+6H+═3S↓+3H2O,故D正确;
故选:A.
点评 本题考查了离子方程式、化学方程式的书写,明确物质的性质及发生反应的实质是解题关键,注意硫氧化性较弱与变价金属反应得到低价态硫化物,题目难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
| pH | 6.5~6.8 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
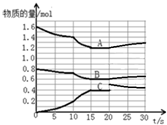 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )| A. | 反应在前10s 内v(B)=0.005mol/(L.s) | |
| B. | 方程式计量数a:b:c为2:1:2 | |
| C. | 10 s时改变条件可能是升高温度,20s时平衡逆向进行 | |
| D. | 15~20s间,反应的平衡常数是2.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
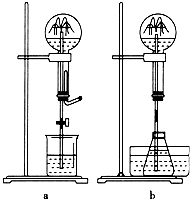 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中转移电子1.0mol | B. | 产生NO2气体0.26mol | ||
| C. | 原HNO3浓度为8.0mol/L | D. | 原HNO3浓度为6.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
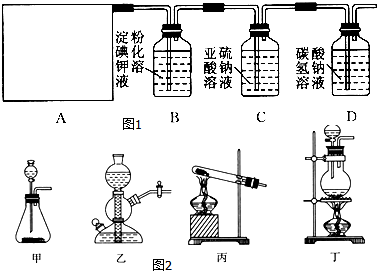
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
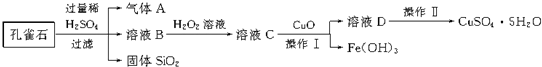
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
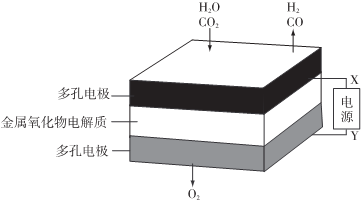
| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com