
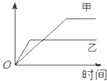
 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( )| 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中2NH3═N2+3H2△H<0 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2, N2+3H2═2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2molSO2和1molO2,在相同温度下 2SO2+O2═2SO3 | SO3物质的量 | 2个大气压 | 10个大气压 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
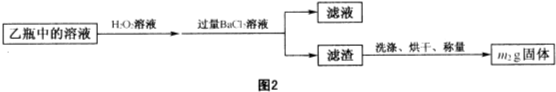
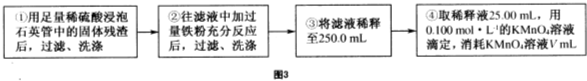
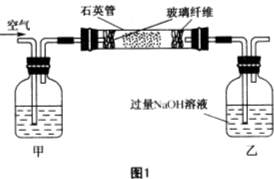 黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
| ||
- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4v(NH3)=5v(O2) |
| B、5v(O2)=6v(H2O) |
| C、3v(NH3)=2v(H2O) |
| D、5v(O2)=4v(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| n(CO2) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O、Na2O2组成元素相同,但与CO2反应的产物不同 |
| B、2Na2O2+2H2O═4NaOH+O2↑ Na2O2是氧化剂H2O是还原剂 |
| C、Na2O2溶于水产生O2的离子方程式为:Na2O2+H2O═2Na++2OH-十O2↑ |
| D、Na2O2用作呼吸面具的供氧剂时氧元素即被氧化又被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com