
| A、Na2O、Na2O2组成元素相同,但与CO2反应的产物不同 |
| B、2Na2O2+2H2O═4NaOH+O2↑ Na2O2是氧化剂H2O是还原剂 |
| C、Na2O2溶于水产生O2的离子方程式为:Na2O2+H2O═2Na++2OH-十O2↑ |
| D、Na2O2用作呼吸面具的供氧剂时氧元素即被氧化又被还原 |


科目:高中化学 来源: 题型:
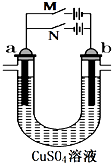 第一阶段:合上M断开N,a极上产224mL(标准状况,下同)气体,b极上有金属析出;
第一阶段:合上M断开N,a极上产224mL(标准状况,下同)气体,b极上有金属析出;查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它是纯天然饮品,不含任何化学物质 |
| B、它清洁、纯净,但长期饮用对健康无益 |
| C、它含有人体所需的矿物质和多种微量元素 |
| D、用催化剂可将它转化为汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
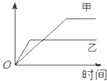 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( )| 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中2NH3═N2+3H2△H<0 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2, N2+3H2═2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2molSO2和1molO2,在相同温度下 2SO2+O2═2SO3 | SO3物质的量 | 2个大气压 | 10个大气压 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用加热法可除去Na2CO3中的NaHCO3 |
| B、Na2CO3的热稳定性大于NaHCO3 |
| C、可用石灰水区分Na2CO3与NaHCO3溶液 |
| D、小苏打可中和胃酸、热纯碱可除去油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同时增大 |
| B、同时减少 |
| C、v1增大,v2减少 |
| D、v1减少,v2增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验示意图 | 实验现象 | 解释 |
甲: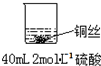 | 无明显现象 | |
乙: | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
| 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO3=Na++H++SO32- |
| B、BaSO4?Ba2++SO42- |
| C、S2-+2H2O?H2S+2OH- |
| D、HCl+H2O=H3O++Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com